题目内容
【题目】下列化学用语表示正确的是( )
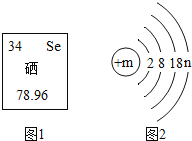
A. 两个氮原子:N2 B. 熟石灰的化学式:Ca(OH)2
C. 正二价的镁元素:Mg+2 D. 铝与盐酸的反应:Al+2HCl=AlCl2+H2↑
【答案】B
【解析】A、原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,所以两个氮原子,就可表示为2N,故选项错误;
B、熟石灰是氢氧化钙的俗称,其中钙显+2价;氢氧根显-1价;化学式为:Ca(OH)2,故选项正确;
C、元素的化合价表在元素的正上方,故选项错误;
D、Al与盐酸反应生成氯化铝和氢气,反应为2Al+6HCl=2AlCl3+3H2↑,故选项错误。

 阅读快车系列答案
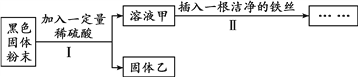
阅读快车系列答案【题目】小明在实验室发现一瓶天然碱样品,其中可能含有碳酸钠和碳酸氢钠,他们是一对“好兄弟”,小明对他们的性质、组成和变化进行探究。
【查阅资料】
(1)20 ℃时,碳酸钠溶解度是21.5克,碳酸氢钠溶解度是9.6克。
(2)2NaHCO3+ Ca(OH)2= Na2CO3 +CaCO3↓+H2O
(3)Ca(HCO3)2 +Na2CO3= CaCO3↓+2NaHCO3
(4)CaCl2 稀溶液与 NaHCO3稀溶液混合无沉淀、与Na2CO3稀溶液混合有沉淀
Ⅰ.了解他们的性质
(1)有道菜叫猪肚炒大蒜,猪肚美味又营养,但最大的烦恼就是难以清洗,人们常加入碳酸钠来去除油腻和异味,这是利用其溶液显________(填“酸”或“碱”)性。
(2)20 ℃时,向饱和碳酸钠溶液中通入足量的二氧化碳,看到白色浑浊,小明经过推理可能发生化合反应,则生成物是______________,钠盐均溶于水,为什么浑浊呢?查阅资料:白色浑浊的原因是____________________________________________________。
(3)在老师的指导下,小明同学设计了如图装置,用碳酸钠和碳酸氢钠做了对比实验。实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊。
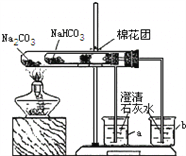
试回答:① 结论:_______(填“碳酸钠”或“碳酸氢钠”)受热分解出水和CO2等物质 ;
②写出b烧杯中发生反应的化学方程式________________。
Ⅱ.探究样品的成分
【提出问题】天然碱样品含有什么成分?
【假设猜想】
假设一:天然碱成分为碳酸氢钠;
假设二:天然碱成分为碳酸钠;
假设三:天然碱成分为____________________。
【实验方案】
下列操作可选药品:NaOH溶液、 稀盐酸、 Ca(OH)2溶液、 CaCl2溶液
实验操作 | 实验现象 | 实验结论 |
操作一:取天然碱样品少量溶于足量水后,加入过量的___________(如果操作一有沉淀,则进行操作二) | 无沉淀出现 | 假设一成立 |
操作二:待操作一中反应充分后过滤,并在滤液中加入过量的_________________,观察。 | __________ | 假设二成立 |
现象略 | 假设三成立 |
【结论】假设一成立
Ⅲ.记录变化的过程
(1)若该样品为碳酸氢钠,加入到盛有足量稀盐酸的烧杯中(烧杯质量为116.9克),不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯和混合物的总质量(m)与反应时间(t)关系如图所示,求所得溶液中溶质质量分数___________________。
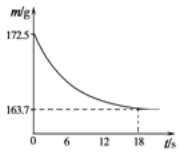
【总结反思】
(2)小明同学在数据分析时发现,若依据上述操作及图表测得的碳酸氢钠质量比真实值大,则可能原因是__________________________________。
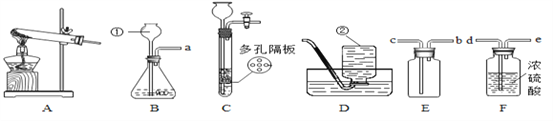
【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
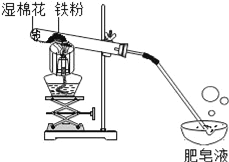
(1)试管尾部放一团湿棉花的目的是____________.
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是____________.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是__.
【实验探究】
实验操作 | 实验现象及结论 |
______________ | ________________ |
【实验结论】铁和水蒸气反应的化学方程式为__.
【反思与交流】该黑色固体不可能是Fe2O3,理由是__.