题目内容
【题目】为了消除人体碘缺乏病,我国政府规定食用盐必须是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3),1000 g碘盐中约含20 mg碘。计算:
(1)碘酸钾中各元素的质量比m(K)∶m(I)∶m(O)=_____;碘元素的质量分数为_____。
(2)_____mg碘酸钾中含有20 mg碘。
(3)成人每天约需0.15 mg碘,假设这些碘是从碘盐中摄取的,若1000g中碘盐含碘20mg,成人每天需要食用碘盐___g。
【答案】39∶127∶48 59.3% 33.7 7.5
【解析】
(1)根据碘酸钾(KIO3)的化学式可知,各元素的质量比m(K)∶m(I)∶m(O)=39:127:(16×3)=39:127:48;碘元素的质量分数为:![]() ×100%≈59.3%;
×100%≈59.3%;
(2)设需要的碘酸钾质量为x,则x×![]() ×100%=20mg,得x=33.7mg,即33.7mg碘酸钾中含有20 mg碘;
×100%=20mg,得x=33.7mg,即33.7mg碘酸钾中含有20 mg碘;
(3)成人每天约需0.15mg碘,假设这些碘主要是从碘盐中提取,若1000g中碘盐含碘20mg,设成人每天需用碘盐为y,则![]() =
=![]() ,得y=7.5g。
,得y=7.5g。

 长江作业本同步练习册系列答案
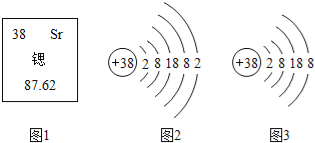
长江作业本同步练习册系列答案【题目】碘被公认为人类的“智慧元素”,如图是元素周期表中关于碘元素的信息。下列关于碘元素的说法错误的是
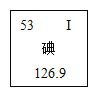
A.碘元素是非金属元素 B.相对原子质量为126.9g
C.原子核内质子数为53 D.原子序数为53
【题目】化学反应条件的控制是实验的灵魂”.某探究小组发现若反应过快,产生的气体不易及时收集,为探究影响过氧化氢溶液分解快慢的因素,于是进行了如下探究:
(提出问题)过氧化氢溶液分解快慢与哪些因素有关呢?
(猜想与假设)猜想一:可能与过氧化氢的质量分数有关;
猜想二:可能与____有关;
猜想三:可能与是否用催化剂有关.
(设计并实验)该探究小组用不同质量分数的过氧化氢溶液在不同温度时进行四次实验.记录所生成的氧气体积和反应所需时间,记录数据如表.
实验 序号 | 过氧化氢的 质量分数 | 过氧化氢溶液 体积(mL) | 温度 | 二氧化锰 的用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
① | 5% | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15% | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30% | 5 | 35 | 2 | 49.21 | |
④ | 30% | 5 | 55 | 2 | 10.76 |
(收集证据)要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号组合是_____(选填“实验序号”).由实验③和④对比可知,化学反应速率与温度的关系是:________./span>
(解释与结论)
(1)通过探究,了解控制过氧化氢分解快慢的方法.请写出过氧化氢溶液在二氧化锰的催化作用下生成氧气的文字表达式为:_____________.
(2)用一定量15%的过氧化氢溶液制氧气,为了减缓反应速率,可加适量的水稀释,所产生氧气的总质量_________.(填“减小”、“增大”或“不变”)