题目内容
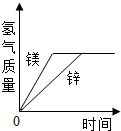 有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示.下列说法正确的有( )
有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示.下列说法正确的有( )①锌一定没有剩余 ②镁一定有剩余
③两种金属产生氢气的速率相等
④消耗镁的质量与消耗锌的质量之比为1:1
⑤消耗的稀盐酸和稀硫酸质量之比为73:98
⑥两种金属产生氢气的质量相等.
| A、两种 | B、三种 | C、四种 | D、五种 |
考点:金属的化学性质
专题:金属与金属材料
分析:本题属于开放性选择题.根据题目给出的信息和图象可以得出产生氢气的量一样多,可以判断出两种金属中有一种剩余,然后根据金属与酸反应存在的关系式M~H2可判断出消耗酸和金属的质量的大小关系,即24:65.再根据金属与酸反应存在的关系式,求酸的质量比.
解答:解:
等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,锌可能有剩余,也可能没有剩余,故①错误,②正确;
根据金属的活动性顺序,镁比锌活泼,因此镁的反应速率快,故③错误;
根据金属与酸反应存在的关系式M~H2可判断出消耗消耗镁的质量与消耗锌的质量之比为24:65.故④错误;
由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故⑤正确;
有图可知:两种金属产生氢气的质量相等.故⑥正确;
故选:B.
等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,锌可能有剩余,也可能没有剩余,故①错误,②正确;
根据金属的活动性顺序,镁比锌活泼,因此镁的反应速率快,故③错误;
根据金属与酸反应存在的关系式M~H2可判断出消耗消耗镁的质量与消耗锌的质量之比为24:65.故④错误;
由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故⑤正确;
有图可知:两种金属产生氢气的质量相等.故⑥正确;
故选:B.
点评:本考点考查了根据化学方程式的计算和金属的化学性质,属于溶质的质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,要注意配平.本考点主要出现在选择题和计算题中.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列物质属于纯净物的是( )
| A、空气 | B、海水 | C、臭氧 | D、生铁 |
研究发现,达菲(Tamiflu)对甲型H1N1流感病毒有抑制作用,从香料八角中提取的莽草酸(C7H10O5)是合成达菲的原料之一.下列对莽草酸的说法不正确的是( )
| A、莽草酸是有机化合物 |
| B、它由碳、氢、氧元素组成 |
| C、氢元素的质量分数最小 |
| D、碳、氢、氧元素的质量比为7﹕10﹕5 |
关于分子、原子、离子的说法,其中正确的是( )
| A、原子是最小的粒子,不可再分 |
| B、当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔 |
| C、钠原子的质子数大于钠离子的质子数 |
| D、分子、原子、离子都可以直接构成物质 |
区分下列各组物质的两种方法都正确的是( )
| 选项 | 需要区分的物质 | 实验方法 |
| A | 涤纶线和羊毛线 | ①观察颜色 ②点燃观察 |
| B | 木炭粉和铁粉 | ①用磁铁吸引②加稀盐酸 |
| C | 稀硫酸和纯碱溶液 | ①闻气味 ②滴加无色酚酞溶液 |
| D | 硬水和软水 | ①加肥皂水 ②过滤 |
| A、A | B、B | C、C | D、D |
下列对应的化学方程式书写完全正确的是( )
A、铁丝在氧气中燃烧:2Fe+3O2
| ||||
B、水通电分解:2H2O
| ||||
C、镁条在空气中燃烧:Mg+O2
| ||||
| D、用澄清石灰水检验二氧化碳气体:CO2+Ca(OH)2=CaCO3↓+H2O |
在四川汶川大地震中,很多同胞失去了宝贵的生命,在这些遇难同胞中,有很多人不是被石块压死,而是在废墟里漫长的等待中严重脱水而死,说明了水对于我们生命的延续是如此的重要,下列关于水的说法中正确的是( )
| A、水是混合物 |
| B、水由氢、氧两个元素组成 |
| C、水由水分子构成 |
| D、水由两个氢原子和一个氧原子构成 |