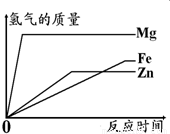
题目内容
如图所示,为等质量的Mg、Zn、Fe与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析:
(1)等质量的三种金属与足量稀硫酸反应产生氢气的质量最少的金属是______;
(2)与相同浓度的稀硫酸反应时反应最快的金属是______;
(3)据图分析,实验室制氢气时应选择与稀硫酸反应的金属是______,理由是______.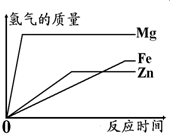
(1)等质量的三种金属与足量稀硫酸反应产生氢气的质量最少的金属是______;
(2)与相同浓度的稀硫酸反应时反应最快的金属是______;
(3)据图分析,实验室制氢气时应选择与稀硫酸反应的金属是______,理由是______.

(1)依据氢气的质量=
×金属的质量,而Mg、Zn、Fe的相对原子质量分别是24、65、56,化合价均是+2,且质量相等,所以等质量的三种金属与足量稀硫酸反应产生氢气的质量最少的金属是Zn;
(2)Mg、Zn、Fe三种金属的活动性顺序是Mg>Zn>Fe,所以与相同浓度的稀硫酸反应时反应最快的金属是镁,表现在图象中应该是斜率最大的物质;
(3)据图分析可知镁的反应速度很快,铁太慢,而锌的反应速度较适中,这样方便在制取气体是的收集操作;
故答案为:(1)Zn;(2)Mg;(3)Zn;其反应速率适中便于收集气体气体;
| 金属的化合价 |
| 金属的相对原子质量 |
(2)Mg、Zn、Fe三种金属的活动性顺序是Mg>Zn>Fe,所以与相同浓度的稀硫酸反应时反应最快的金属是镁,表现在图象中应该是斜率最大的物质;
(3)据图分析可知镁的反应速度很快,铁太慢,而锌的反应速度较适中,这样方便在制取气体是的收集操作;
故答案为:(1)Zn;(2)Mg;(3)Zn;其反应速率适中便于收集气体气体;

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
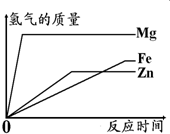 如图所示,为等质量的Mg、Zn、Fe与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析:
如图所示,为等质量的Mg、Zn、Fe与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析: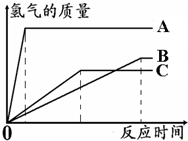 如图所示,为等质量的A、B、C与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析:
如图所示,为等质量的A、B、C与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析: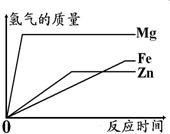 如图所示,为等质量的Mg、Zn、Fe与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析:
如图所示,为等质量的Mg、Zn、Fe与足量相同浓度的稀硫酸反应的关系.横坐标表示反应时间,纵坐标表示生成氢气的质量.据此分析: