题目内容
金属材料和水在生产和生活中有着广泛应用。

(1)从右图是水的组成测定的实验,此反应的方程式为 。
(2)水是很好的溶剂。下表是KNO3和KCl在不同温度时的溶解度,请回答下列问题:
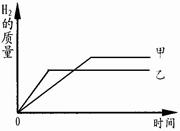
①40 ℃时,向两个分别盛有45 g KNO3和KCl固体的烧杯中,各加入100g的水,充分溶解后,结果如右图所示,则乙烧杯中的溶质是 。

②采用任意一种操作方法,将上述烧杯中的剩余固体全部溶解,并将溶液变为不饱和溶液。下列说法中正确的是 (填字母)。
A.溶剂质量可能不变 B.溶液中溶质的质量分数一定增大
C.溶液质量一定增大 D.可采用升温或加水的方法
(3)从下图可知金属具有导热性的是 。

A.铁锅 B.铜导线 C.铝箔
(4)铁制品在空气中会发生锈蚀,其原因是铁与空气中的 共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是 (要求一种方法即可)。
(5)在探究金属的化学性质时,某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 、 。
(6)小明向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,待充分反应后,滤液呈浅绿色。根据此现象作出了下列判断,你认为正确的是 (填写序号)。
A.滤纸上一定有Cu,可能有Fe,一定没有Mg
B.滤纸上一定有Fe,可能有Mg、Cu
C.滤液中一定有FeSO4,可能有MgSO4、CuSO4
D.滤液中一定有MgSO4、FeSO4,一定没有CuSO4

(1)从右图是水的组成测定的实验,此反应的方程式为 。
(2)水是很好的溶剂。下表是KNO3和KCl在不同温度时的溶解度,请回答下列问题:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |

②采用任意一种操作方法,将上述烧杯中的剩余固体全部溶解,并将溶液变为不饱和溶液。下列说法中正确的是 (填字母)。
A.溶剂质量可能不变 B.溶液中溶质的质量分数一定增大
C.溶液质量一定增大 D.可采用升温或加水的方法
(3)从下图可知金属具有导热性的是 。

A.铁锅 B.铜导线 C.铝箔
(4)铁制品在空气中会发生锈蚀,其原因是铁与空气中的 共同作用的结果。为防止钢铁制品的锈蚀,厨房中的铁锅和菜刀通常需做的防护是 (要求一种方法即可)。
(5)在探究金属的化学性质时,某同学将带锈铁钉放入稀盐酸中,观察到铁锈逐渐消失,溶液由无色逐渐变成黄色,并有气泡产生,有关反应的化学方程式为 、 。
(6)小明向含有FeSO4和CuSO4两种溶质的溶液中,加入一定质量镁粉,待充分反应后,滤液呈浅绿色。根据此现象作出了下列判断,你认为正确的是 (填写序号)。
A.滤纸上一定有Cu,可能有Fe,一定没有Mg
B.滤纸上一定有Fe,可能有Mg、Cu
C.滤液中一定有FeSO4,可能有MgSO4、CuSO4
D.滤液中一定有MgSO4、FeSO4,一定没有CuSO4
(1)2H2O通电2H2↑+O2↑ (2)① KNO3 ②A、 D (3)A
(4)氧气和水 擦干或涂油
(5)Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe + 2HCl = FeCl2 + H2↑
(6)A D
(4)氧气和水 擦干或涂油
(5)Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe + 2HCl = FeCl2 + H2↑
(6)A D
试题分析:(1)水通电分解生成氢气和氧气;(2)①如表格所示,该温度下硝酸钾溶解度为63.9g,也就是该温度下一百克水中最多可以溶解63.9g,有图可知乙物质是全部溶解所以乙物质是熊酸钾,②采用升温或者加水的方法均可以使两溶液达到不饱和状态,在这个过程中溶液质量可能不变,也可能增大;(3)铁锅可以用来做饭是利用了其可移导热的物理性质;(4)铁生锈是和空气中的氧气、水反应生成三氧化二铁的过程,防止其生锈可以保持表面干燥,涂油等;(5)有气泡冒出是铁和盐酸反应生成氯化亚铁和氢气的反应,溶液变为黄色是三氧化二铁和盐酸反应生成氯化铁和水的过程;(6)溶液中一定有最活泼金属的盐,不溶物中一定有最不活泼金属的单质,滤液为浅绿色说明有亚铁离子剩余,所以硫酸铜已经没有剩余,所以滤纸上一定有Cu,可能有Fe,一定没有Mg,滤液中一定有MgSO4、FeSO4,一定没有CuSO4。
点评:本题属于对化学常识的考察,近几年中考加大了对化学常识记的考查力度,特别是和生活联系较为紧密的。

练习册系列答案
相关题目