题目内容
【题目】将含有可溶性杂质的某氯化钠样品3g溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入200g一定溶质的质量分数的AgNO3溶液(杂质不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如右图所示。试计算:
(提示:NaCl + AgNO3 = AgCl↓+ NaNO3 )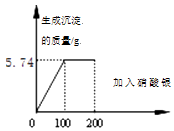
(1)恰好完全反应时生成沉淀质量为g;
(2)硝酸银溶液中溶质的质量分数是多少?
【答案】
(1)5.74
(2)解:由图可知,恰好完全反应时生成沉淀质量为5.74g
设硝酸银溶液中硝酸银的质量为X
NaCl + | AgNO3 = | AgCl↓ + NaNO3 |
170 | 143.5 | |
x | 5.74g |
列比例式得:170:143.5= X:5.74g 解得:X =6.8 g
硝酸银溶液中硝酸银的质量分数为6.8g/200g×100% =3.4%
【解析】根据图像可知,产生沉淀质量为5.74g,则根据化学方程式的计算即可算得。
所以答案是:5.74;
解:由图可知,恰好完全反应时生成沉淀质量为5.74g
设硝酸银溶液中硝酸银的质量为X
NaCl + | AgNO3 = | AgCl↓ + NaNO3 |
170 | 143.5 | |
x | 5.74g |
列比例式得:170:143.5= X:5.74g 解得:X =6.8 g
硝酸银溶液中硝酸银的质量分数为6.8g/200g×100% =3.4%
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

【题目】张华同学对酸、碱、盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | ZnCl2 | FeCl2 |
思考:根据以上盐中的金属元素的排列,可以得出他是依据顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在右边的圆圈中填入适当的化学式或离子符号:
(3)张华同学发现酸、碱、盐之间的反应都有盐类物质生成。请写出一个能生成MgCl2的复分解反应的化学方程式:。
(4)我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢?
猜想与假设:盐溶液的pH可能为:pH=7、pH<7、pH>7.
设计与实验:下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验:甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.
记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液 | CuSO4溶液 | K2CO3溶液 | |
甲同学 | 7 | 4 | 10 |
乙同学 | 7 | 5 | 9 |
结论:通过测定几种盐溶液的pH,可以得出的结论是: .
评价与反思:上述两同学测得的数据,反映了溶液真实pH的是同学。

