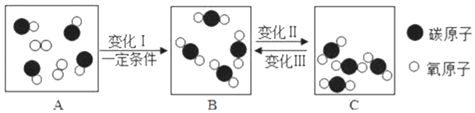
��Ŀ����
����Ŀ�����ƶ��桱��һ�ֳ������˲��Ƶ�ҩ�������Ҫ�ɷ���̼��ơ�Ϊ�˲ⶨ���ƶ��桱��̼��Ƶĺ�����С����ȡ20.0g����ĸƶ�����Ʒ�����ձ��У��������м�����60.0g����ǡ����ȫ��Ӧ������ƶ����г�̼�����������ɷֶ�������ˮ���Ҳ���ϡ���ᷴӦ������Ӧ���ձ������ʵ�������Ϊ73.4g������ˮ����������������м��㣺

��1��������ǡ�÷�Ӧʱ�����ɶ�����̼��������_______�ˣ�
�ڡ��ƶ��桱��Ʒ��̼��Ƶ�������_______�ˣ�
��2����̼���ǡ����ȫ��Ӧʱ������Һ�����ʵ���������_______���������һλС������
���𰸡�6.6 15 24.3%
��������
�⣺��1�����������غ㶨�ɣ����ɶ�����̼������Ϊ60.0g+20.0g��73.4g��6.6g��
��2����30g�ƶ�����̼��Ƶ�����Ϊx�������Ȼ��Ƶ�����Ϊy��
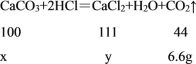
![]() =
=![]()
x��15g
![]() =
=![]()
y��16.65g
������Һ�����ʵ�����������![]() ��100%��24.3%��
��100%��24.3%��
��30g�ƶ�����̼��Ƶ�����Ϊ15g�������Ȼ��Ƶ�����Ϊ16.65g��������Һ�����ʵ���������24.3%��

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
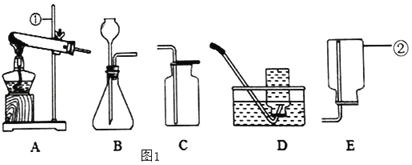
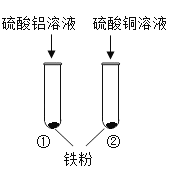
�ٷ�ѧ����ҵ��������ϵ�д�����Ŀ��ij��ѧ��ȤС���ͬѧΪ��̽������������أ��������ͼװ�ý���ʵ�顣ʵ��ʱ�����ǽ�һö�ྻ����������ʳ��ˮ��![]() ��ͼ��װ������������
��ͼ��װ������������![]() ��һ��ʱ����й۲졣����һ��������������ɺ���ʵ����ơ�
��һ��ʱ����й۲졣����һ��������������ɺ���ʵ����ơ�
���۲�����
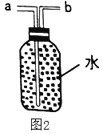
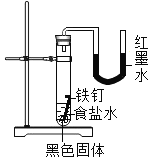
![]() װ���Ҳ�U�ι��еĺ�īˮҺ������ҵͣ�
װ���Ҳ�U�ι��еĺ�īˮҺ������ҵͣ�![]() �������⣬�Թܵײ��к�ɫ�������ʡ�
�������⣬�Թܵײ��к�ɫ�������ʡ�
��������⣩U�ι��еĺ�īˮҺ��Ϊ������ҵͣ���ɫ������������ʲô��
�����۷�������С��Ļ�ѧ����ѧ����֪ʶ������֪����īˮҺ������ҵ͵�ԭ����______��
����������裩��С���е�С��ͬѧ�²�ú�ɫ������ܺ��У�![]() ��
��![]() ��
��![]() ��
��![]() ���������ʡ�
���������ʡ�
����������֤����ʵ��С��ͬѧ����С�������ֲ²���������
(1)Сǿͬѧ��Ϊһ������̼���ý���Ҳ�õ�С��ͬѧ���Ͽɣ�������______��
(2)��С���ͬѧ����ȷ����ɫ�������Ƿ��������������������Ʒ�������ȷ�ϣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
��ѡ�õ��Լ��� ______ | ______ | ______ |
��֪ʶ���ӣ�������һ���ڼ������������ֱ���ˮ��ʳ��ˮ�������ʵ�飬��Ľ���֮һ��������______![]() �ˮ����ʳ��ˮ��
�ˮ����ʳ��ˮ��![]() ������졣
������졣
������̽��������������ʵ��̽��Ӱ�����������������������______��
����Ŀ����ѧ�����������ߣ��������ǵ�����ϢϢ��ء�
(1)д����������Ҫ��Ļ�ѧ���š�
����Ȼ����Ӳ������_______���ڵؿ��к�����ߵĽ���Ԫ��______��
�����ֵ�����________���ܱ�������������Ļ��ϼ�_________��
ˮ����Ҫ�ɷ�(ug/100mL) |
ƫ����(H2SiO3)��180 ����400 ����80 ����35 pH(25��)7.3��0.5 |
(2)ijƷ�ƿ�Ȫˮ��ǩ�ϱ����Ŀ�Ȫˮ��Ҫ�ɷ����±���ʾ��������±��ش��������⣺
�������ÿ�Ȫˮƿ�IJ�������_______(�ϳɡ�����)���ϣ�
�������ӵĻ�ѧ������___________��
�ۼ����Ʒ������ˮΪ��ˮ�ķ�����___________��
����д���ÿ�Ȫˮƿ�ڳ��л�ѧʵ��Ӧ���е�һ��ʵ��________��