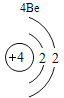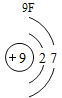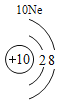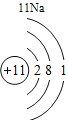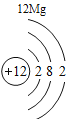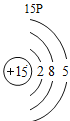题目内容
【题目】为探究碱的化学性质,实验小组进行了如下实验。
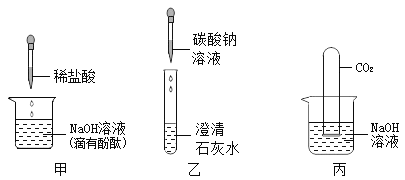
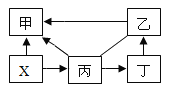
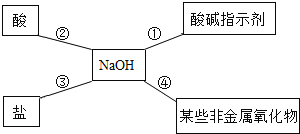
(1)甲实验:加入一定量的稀盐酸后,观察到____________,说明稀盐酸和NaOH发生了反应,该反应的化学方程式为_____________。
(2)乙实验:由该实验的现象可知碱能与某些______________(填物质类别)发生反应。
(3)丙实验:将充满CO2的试管倒扣在NaOH溶液的烧杯中(如图),一段时间后,可观察到的实验现象为_____,某同学认为该实验可证明NaOH与CO2发生了反应。
(4)小组同学提出了质疑,认为丙实验还不足以证明CO2与NaOH确实发生了反应,理由是_____________,需补充对照实验将氢氧化钠溶液换成_______为确定丙实验反应后所得溶液中溶质的成分,小组同学进行了如下探究:
[提出猜想]猜想一:碳酸钠;猜想二:碳酸钠和氢氧化钠。
[设计实验]请你和小组同学一起完成下列表格。
实验操作 | 实验现象 | 实验结论 |
①取一定量反应后的溶液于试管中,滴加_______溶液,过滤 | _________。 | 猜想二正确 |
②向滤液中滴加___________。 | 溶液由无色变为红色 |
[实验反思]敞口放置的氢氧化钠溶液易变质,某同学用少量的稀盐酸鉴定某敞口试剂瓶中的氢氧化钠溶液是否变质,发现无气泡冒出,该同学认为氢氧化钠溶液没有变质,大胆猜想该结论不合理的原因:
①____________________________。
②____________________________。
【答案】烧杯中溶液由红色变成无色 ![]() 盐 试管内的液面上升 二氧化碳能溶 于水且能与水发生反应 等体积的水 足量的氯化钡(其他合理答案均可) 有白 色沉淀生成 无色酚酞溶液 盐酸量不足,可能生成碳酸氢钠和氯化钠 盐酸量不足,可能盐酸和碳酸钠反应生成的二氧化碳被氢氧化钠溶液吸收了
盐 试管内的液面上升 二氧化碳能溶 于水且能与水发生反应 等体积的水 足量的氯化钡(其他合理答案均可) 有白 色沉淀生成 无色酚酞溶液 盐酸量不足,可能生成碳酸氢钠和氯化钠 盐酸量不足,可能盐酸和碳酸钠反应生成的二氧化碳被氢氧化钠溶液吸收了
【解析】
(1)氯化钠溶液显中性,氢氧化钠显碱性,盐酸显酸性,酚酞溶液在中性和酸性溶液中不变色,酚酞溶液遇碱性溶液变红色,所以滴加盐酸到一定量时,溶液由红色变成无色,说明溶液中氢氧化钠已反应完,证明氢氧化钠能与盐酸反应;
(2)澄清石灰水与碳酸钠反应会生成碳酸钙白色沉淀,碳酸钠属于盐,因此由该实验的现象可知碱能与某些盐发生反应;
(3)NaOH与CO2发生了反应,试管内气压减小,可观察到试管内液面上升;
(4)小组同学认为丙实验还不足以证明CO2与NaOH确实发生了反应,理由是二氧化碳也能与水发生反应,故需补充对照实验将氢氧化钠溶液换成等体积的水;
[设计实验]氢氧化钠溶液和碳酸钠溶液都显碱性,要证明二氧化碳与氢氧化钠反应后所得溶液中既有碳酸钠,又有氢氧化钠,可先将碳酸钠完全转化为难溶性碳酸盐,再检验溶液中是否有氢氧化钠,但转化碳酸钠时不能引入OH-,因此实验操作为取二氧化碳与氢氧化钠反应后所得溶液于试管中,滴人足量的氯化钡或氯化钙等溶液,充分反应后,取上层清液滴人无色酚酞溶液,如果观察到加人氯化钡或氯化钙等溶液时有白色沉淀生成,滴人无色酚酞溶液时溶液由无色变为红色,则说明反应后所得溶液中既有碳酸钠,也有氢氧化钠;
[实验反思]若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,可能原因是:1盐酸量不足,可能生成碳酸氢钠和氯化钠;2、盐酸量不足,可能盐酸和碳酸钠反应生成的二氧化碳被氢氧化钠溶液吸收了。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】宏宏同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶塞。对于该溶液是否变质,宏宏邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(提出问题1)该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液于试管中,滴加足量稀盐酸 | 有______产生 | 说明该溶液已变质,变质的原因是________(用化学方程式表示) |
(提出问题2)该溶液变质程度怎样?
(提出猜想)猜想一:已完全变质,该溶液中溶质只含Na2CO3;
猜想二:部分变质,该溶液中溶质含有__。
(查阅资料)氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液于试管中,加入过量氯化钡溶液 | 有______产生 | 猜想______成立 |
静置,取上层清液于另一只试管中,加入2-3滴酚酞溶液 | 上层清液变红 |
(提出问题3)怎样提纯该样品得到纯净的氢氧化钠固体?
(实验探究3)为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
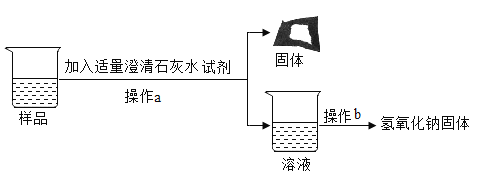
根据实验流程可知,最终所得氢氧化钠固体质量__(填“大于”“小于”或“等于”)变质后样品中氢氧化钠的质量。
(反思交流)在(实验探究2)中加入过量的氯化钡溶液的目的是__。
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容),回答有关问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
(1)请写出关于铍元素的一条信息_________________________________。
(2)表中3号和11号元素原子的最外层电子数相同,都易__________(填“得到”或“失去”)电子。钠元素和氟元素组成化合物的化学式为___________,构成该物质的微粒是___________(填“分子”原子”或“离子”)。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是____________(填字母序号)。
a.C和Ne
b.Be和Mg
C.Al和Si
d.S和O
(4)氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为____________________________。
【题目】小明同学欲测定部分变质的氢氧化钠中碳酸钠的含量(含少量其他不溶性杂质),进行了如下实验:①取50g样品,加入足量水,待完全冷却后滤去不溶物,将得到的滤液平均分成五等份,倒入五个烧杯中;②向五个烧杯中分别加入一定质量14.6%的盐酸;③将充分反应后得到的溶液进行称量。实验过程中图像和所得数据如下,请你分析并进行有关计算:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | 烧杯Ⅳ | 烧杯Ⅴ | |
加入盐酸的质量(g) | 25 | 50 | 75 | 100 | 140 |
烧杯中溶液质量(g) | 55 | 80 | 104.78 | 129.34 | 168.9 |
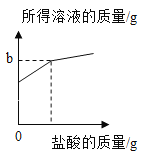
(1)通过分析上述图像及实验数据,烧杯中盐酸已经过量的有_______________________。
(2)样品中碳酸钠的质量分数是_____________?
(3)每份样品溶液的质量为______;坐标中b=_______________。
【题目】按要求填空:
(1)空气中含量最多的气体___________(填化学式),标出氯酸钾中氯元素的化合价____________。
(2)下表列出的是某品种西瓜每100g食用部分的主要营养成分数据。
营养成分 | 水分 | 蛋白质 | 脂肪 | 糖类 | X | 钙铁锌 |
质量 | 92.5g | 0.7g | 0.2g | 6.1g | 6.8mg | 17.1mg |
表中“X”是指人体所需六大基本营养素中的_________,西瓜中含有的__________元素可预防贫血。
(3)图中表示氧化汞分子受热分解发生反应的示意图:

根据上图你能获得的信息有:_______________(填符合题意的2条即可)。