题目内容
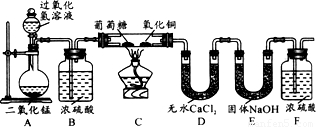
某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).称取1.8g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g.则下列推断正确的是( )
A.该物质一定含有C、H元素,可能有O元素
B.该物质一定含有C、H、O元素
C.用充有空气的储气球代替装置A,有利于实验的进行
D.氧化铜的有无对实验结果没有影响
【答案】分析:根据质量守恒定律结合生成物可以判定该物质中含有的元素,即根据D装置中氯化钙所吸收的水分,可以判定出氢元素的质量,根据E装置所吸收的二氧化碳来判定碳元素的质量,然后与题给物质的质量比较即可;
解答:解:该物质燃烧生成了二氧化碳和水,根据质量守恒定律可以知道判断出该物质中一定含有碳元素和氢元素,D装置增重1.08g,而D装置吸收的是水,故生成水的质量为1.08g,其中含有的氢元素的质量为:1.08g× ×100%=0.12g;
×100%=0.12g;
而E装置中吸收的是二氧化碳,可以知道生成二氧化碳的质量为2.64g,其中碳元素的质量为:2.64g×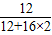 ×100%=0.72g,
×100%=0.72g,
而水中的氢元素的质量、二氧化碳中碳元素的质量与该物质中含有的氢元素和氧元素的质量相等,所以题给物质含有的氢元素和碳元素的质量为:0.12g+0.72g=0.84g<1.8g,所以在该物质中还含有氧元素;
故选B
点评:本题是一道综合实验题,主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
解答:解:该物质燃烧生成了二氧化碳和水,根据质量守恒定律可以知道判断出该物质中一定含有碳元素和氢元素,D装置增重1.08g,而D装置吸收的是水,故生成水的质量为1.08g,其中含有的氢元素的质量为:1.08g×
 ×100%=0.12g;
×100%=0.12g;而E装置中吸收的是二氧化碳,可以知道生成二氧化碳的质量为2.64g,其中碳元素的质量为:2.64g×
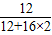 ×100%=0.72g,
×100%=0.72g,而水中的氢元素的质量、二氧化碳中碳元素的质量与该物质中含有的氢元素和氧元素的质量相等,所以题给物质含有的氢元素和碳元素的质量为:0.12g+0.72g=0.84g<1.8g,所以在该物质中还含有氧元素;
故选B
点评:本题是一道综合实验题,主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目

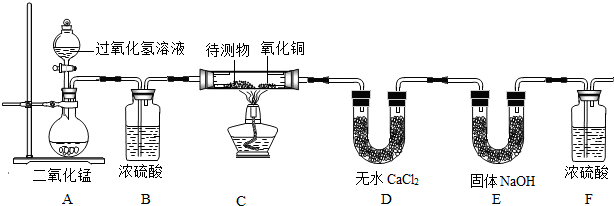
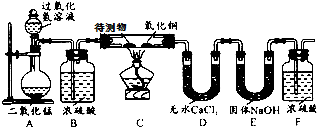 某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如下图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).称取1.8g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g.则下列推断正确的是待测物( )
某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如下图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).称取1.8g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g.则下列推断正确的是待测物( )