题目内容
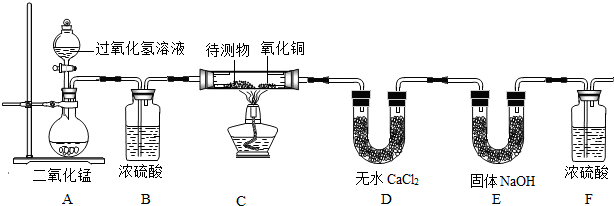
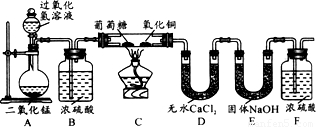
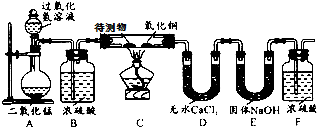 某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如下图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).称取1.8g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g.则下列推断正确的是待测物( )
某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如下图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).称取1.8g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g.则下列推断正确的是待测物( )分析:D装置增重1.08g,说明燃烧生成水的质量是1.08g,E装置增重2.64g,说明生成二氧化碳的质量是2.64g,根据质量守恒定律可以计算参加反应的氧气的质量,通过水的质量可以计算氢元素的质量,通过二氧化碳的质量可以计算碳元素的质量.
解答:解:1.8g待测物完全燃烧需要氧气的质量为:1.08g+2.64g-1.8g=1.92g,
1.08g水中氢元素的质量为:1.08g×
×100%=0.12g,则氧元素的质量为:1.08g-0.12g=0.96g;
2.64g二氧化碳中碳元素的质量为:2.64g×
×100%=0.72g,则氧元素的质量为:2.64g-0.72g=1.92g;
由计算可知,待测物中含有0.72g碳元素、0.12g氢元素,含有氧元素的质量为:0.96g+1.92g-1.92g=0.96g;
D正确;A不正确;如果待测物不完全燃烧时能生成一氧化碳,加热时一氧化碳能和氧化铜反应,所以氧化铜的有无对实验结果有影响,B不正确;空气中含有二氧化碳,对实验结果有影响,C不正确.
故选:D.
1.08g水中氢元素的质量为:1.08g×
| 2 |
| 18 |
2.64g二氧化碳中碳元素的质量为:2.64g×
| 12 |
| 44 |
由计算可知,待测物中含有0.72g碳元素、0.12g氢元素,含有氧元素的质量为:0.96g+1.92g-1.92g=0.96g;
D正确;A不正确;如果待测物不完全燃烧时能生成一氧化碳,加热时一氧化碳能和氧化铜反应,所以氧化铜的有无对实验结果有影响,B不正确;空气中含有二氧化碳,对实验结果有影响,C不正确.
故选:D.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目