题目内容
【题目】闪锌矿(主要成分为ZnS)经熔烧得锌熔砂,锌熔砂主要含ZnO、ZnFe2O4,以及少量CuO,工业上用其制备金属锌,具体过程如图所示。
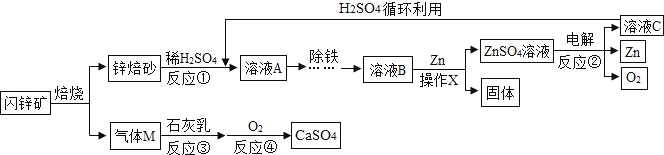
(1)进行反应①时,要将锌熔砂粉粹成细小颗粒,目的是_____。
(2)操作X的名称是_____;经该操作得到的ZnSO4溶液仍然浑浊,可能的原因是_____。
(3)ZnFe2O4可看作两种氧化物的结合物,与稀H2SO4反应产生两种盐,分别是ZnSO4和_____(填化学式)。
(4)参加反应②的物质为ZnSO4和_____(填化学式)。
(5)气体M如果直接排放,会造成的大气污染,气体M为_____(填名称)。
(6)写出反应④的化学方程式_____。
【答案】增大反应物的接触面积,使反应更加充分快速 过滤; 漏斗内的液面高于滤纸的边缘 Fe2(SO4)3 H2O 二氧化硫 2CaSO3+O2=2CaSO4
【解析】
(1)增大反应物的接触面积可以加快反应的速率,所以进行反应①时,要将锌熔砂粉粹成细小颗粒,目的是加快反应的速率;故填:增大反应物的接触面积,使反应更加充分快速;
(2)过滤可以将不溶性固体从溶液中分离出来,操作X的名称是过滤,经该操作得到的ZnSO4溶液仍然浑浊,可能的原因是漏斗内的液面高于滤纸的边缘或滤纸破损等;故填:过滤;漏斗内的液面高于滤纸的边缘;
(3)ZnFe2O4可看作氧化锌、氧化铁两种氧化物的结合,氧化锌和硫酸反应生成硫酸锌和水,氧化铁和硫酸反应生成硫酸铁和水;故填:Fe2(SO4)3;
(4)硫酸锌、水在通电的条件下生成锌、硫酸和氧气,故填:H2O;
(5)化学反应前后,元素种类不变,原子个数不变,所以气体M是SO2.故填:二氧化硫;
(6)亚硫酸钙与氧气反应生成硫酸钙;故填:2CaSO3+O2=2CaSO4。

【题目】某校学习小组准备探究气体的测定和数据处理方法。
(提出问题)
如何利用石灰石(主要成分为CaCO3)与稀盐酸反应来测定生成CO2的质量和体积,并处理数据。
(实验设计)通过下列两个实验分别测定CO2的质量和体积:
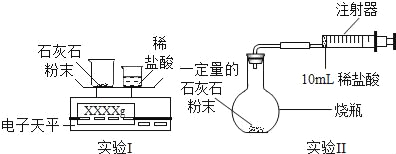
(分析与表达)
(1)上述两个实验中,反应的化学方程式是_____。
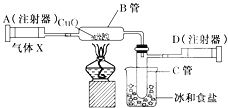
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是_____。
(3)实验Ⅱ中,先连接好装置,再_____(填操作名称),然后装好药品,最后将10ml稀盐酸快速推入烧瓶中。若稀盐酸是缓慢推入的,则可能造成的后果是
_____。
(记录与处理)
(4)已知实验I反应前的总质量[m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)],要计算生成CO2的质量,至少还需要的数据是_____。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
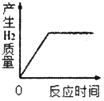
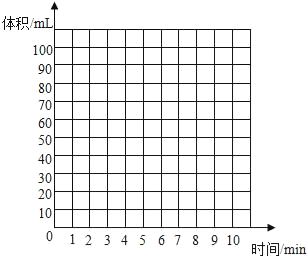
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
①根据以上实验过程和数据综合分析,最终生成CO2的体积是_____mL,理由是_____。
②根据你的认识,在坐标图中绘制出0~10min生成CO2体积随时间变化的曲线。
(反思与评价)
(6)经过分析,你认为实验I的优点是_____,实验Ⅱ的优点是_____。
【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
(查阅资料)(1)、固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
(2)、氯化钙溶液和酒精溶液均呈中性。
(提出问题)固体酒精中的氢氧化钠是否变质?
(实验探究)
(1)、取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的_____,由此说明氢氧化钠已变质。
(2)、为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生_____ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_____。
他们另取烧杯中上层清液,加足量氯化钙溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)(1)、乙组实验中加足量氯化钙溶液的目的是_____。
(2)、乙组实验中能否用澄清石灰水代替氯化钙溶液_____(填“能”或“不能”)。