题目内容
【题目】某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,同学们为了确定该白色固体的成分,进行了如下实验探究。
(资料卡片)BaCl2溶液显中性
I.初步探究:
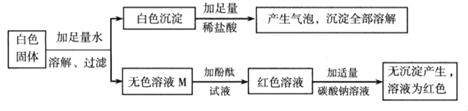
同学们设计的实验过程及现象如图所示。
(初步结论)
(1)原白色固体中一定有的物质是_____一定没有的物质是_____。
(2)M溶液中一定有的溶质是_____。
(交流讨论)
同学们认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否存在氢氧化钠。若要进一步确定,需对溶液M继续探究。
Ⅱ.继续探究:
(提出问题)无色溶液M中存在氢氧化钠吗?
(猜想与假设)
猜想一:存在氢氧化钠
猜想二:不存在氢氧化钠
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管,加入过量的氯化钡溶液,振荡,静置 | _____ | 反应的化学方程式为_____;证明溶液M中有碳酸钠并被除尽。 |
B.取实验A所得上层清液于试管中,加入_____。 | _____ | 猜想一正确 |
同学们通过交流、讨论、实验,圆满地完成了实验活动。
【答案】BaCl2、Na2CO3 Na2SO4 NaCl 有白色沉淀生成 BaCl2+Na2CO3=BaCO3↓+2NaCl 无色酚酞试液 无色变红色
【解析】
根据白色沉淀完全溶于水,且生成气泡可知白色固体中一定有BaCl2、Na2CO3,一定不含Na2SO4,可能 含有NaOH,然后根据相关物质的性质分析解答。
[初步结论](1)根据题目给出的流程图和信息:白色固体中加足量水溶解、过滤,得到白色固体和无色溶液M;白色固体中加足量的稀盐酸,产生气泡,沉淀全部溶解,说明沉淀全部是碳酸钡,即原白色固体中一定有BaCl2、Na2CO3,一定没有硫酸钠,可能有氢氧化钠;
(2)无色溶液M加入酚酞变红,再加入适量的碳酸钠溶液,无沉淀产生,说明M中一定没有氯化钡,一定有氯化钠,因为氯化钡和碳酸钠反应生成碳酸钡白色沉淀和氯化钠;
[探究与结论]A、取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置,有白色沉淀生成,反应的化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,证明溶液M中有碳酸钠并被除尽;
B、取实验A所得上层清液于试管中,加入无色酚酞试液,无色变红色,猜想一正确。