题目内容
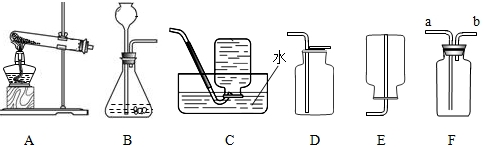
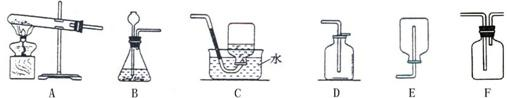
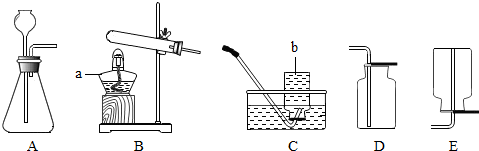
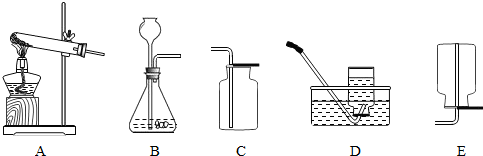
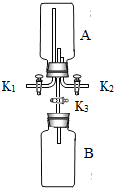
21、下图为实验室制取气体的装置图,回答下列问题:

(1)写出上图仪器的名称:a
(2)用高锰酸钾制取氧气时选用的发生装置为
(3)实验室可选用B装置制取氢气,有关化学方程式为
B装置还可以用来制取CO2,得到的CO2气体可能含有少量水蒸气,欲进行干燥,可选下列物质中的
A.氢氧化钠溶液 B.浓硫酸 C.氯化钠溶液
(4)硫化氢(H2S)是一种有毒气体,其密度比空气大,且能溶于水,水溶液呈酸性.实验室通常用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得.小华同学设计的实验装置为BD组合,你认为此装置是否合理

(1)写出上图仪器的名称:a
试管
,b
长颈漏斗
.(2)用高锰酸钾制取氧气时选用的发生装置为
A
(填编号),反应的化学方程式为
2KMnO4?K2MnO4+MnO2+O2↑
.实验时,还应在试管口放
一团棉花
,以防止加热时高锰酸钾粉末进入导管.(3)实验室可选用B装置制取氢气,有关化学方程式为
Zn+H2SO4=ZnSO4+H2↑
.B装置还可以用来制取CO2,得到的CO2气体可能含有少量水蒸气,欲进行干燥,可选下列物质中的
B
(填序号).A.氢氧化钠溶液 B.浓硫酸 C.氯化钠溶液
(4)硫化氢(H2S)是一种有毒气体,其密度比空气大,且能溶于水,水溶液呈酸性.实验室通常用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得.小华同学设计的实验装置为BD组合,你认为此装置是否合理
不合理
(填“合理”或“不合理”),理由是
硫化氢气体有毒不能在敞口的集气瓶中收集
.分析:(1)了解常见实验仪器,熟悉名称;
(2)根据反应条件是加热选择反应装置;根据反应物和生成物以及反应条件写出反应化学式和反应过程;
(3)根据所学知识书写制取氢气的化学式;常用浓硫酸干燥二氧化碳气体;
(4)收集气体装置要根据硫化氢(H2S)的性质选择装置.
(2)根据反应条件是加热选择反应装置;根据反应物和生成物以及反应条件写出反应化学式和反应过程;
(3)根据所学知识书写制取氢气的化学式;常用浓硫酸干燥二氧化碳气体;
(4)收集气体装置要根据硫化氢(H2S)的性质选择装置.
解答:解:(1)了解常见实验仪器,熟悉名称;图中的仪器名称:a、试管b、长颈漏斗;
(2)反应物是高锰酸钾固体,反应条件是加热;再根据反应物是高锰酸钾,反应条件是加热写出化学反应式;为防止加热时高锰酸钾粉末进入导管.在试管口放一团棉花.故答案为:A、2KMnO4?K2MnO4+MnO2+O2↑、一团棉花;
(3)实验室中常用锌与稀硫酸在常温下反应制取氢气,反应式为:Zn+H2SO4=ZnSO4+H2↑;浓硫酸具有极强的吸水性,可用来干燥二氧化碳气体.故答案为:Zn+H2SO4=ZnSO4+H2↑、B;
(4)硫化氢(H2S)是用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得.可用B装置做发生装置;硫化氢(H2S)虽密度比空气大,但是它是一种有毒气体,不能在敞口的集气瓶中收集,所以不能用D装置做收集装置.故BD装置不合理.故答案为:不合理、硫化氢气体有毒不能在敞口的集气瓶中收集.
(2)反应物是高锰酸钾固体,反应条件是加热;再根据反应物是高锰酸钾,反应条件是加热写出化学反应式;为防止加热时高锰酸钾粉末进入导管.在试管口放一团棉花.故答案为:A、2KMnO4?K2MnO4+MnO2+O2↑、一团棉花;
(3)实验室中常用锌与稀硫酸在常温下反应制取氢气,反应式为:Zn+H2SO4=ZnSO4+H2↑;浓硫酸具有极强的吸水性,可用来干燥二氧化碳气体.故答案为:Zn+H2SO4=ZnSO4+H2↑、B;
(4)硫化氢(H2S)是用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得.可用B装置做发生装置;硫化氢(H2S)虽密度比空气大,但是它是一种有毒气体,不能在敞口的集气瓶中收集,所以不能用D装置做收集装置.故BD装置不合理.故答案为:不合理、硫化氢气体有毒不能在敞口的集气瓶中收集.
点评:以实验装置的连接为切入点,考查常见气体的性质.使学生即了解了气体的性质又熟悉了实验装置的连接原理.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 、
、 、
、 分别表示N2、H2、NH3.在催化剂表面(
分别表示N2、H2、NH3.在催化剂表面( 下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
 微粒的基本性质”的实验探究,实验过程如下:
微粒的基本性质”的实验探究,实验过程如下:
 、
、 、
、 分别表示N2、H2、NH3分子.在催化剂表面
分别表示N2、H2、NH3分子.在催化剂表面 (下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
(下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下: