题目内容
【题目】在探究酸和碱的化学性质时,某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计、实施和评价,并得出有关结论.
(1)探究稀硫酸与氢氧化钠溶液的反应:

当滴入几滴酚酞试液后,溶液由无色变为___色,根据上述实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为:___.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是___(填“方案一”或“方案二”)另外一个实验方案错误的原因是(用化学方程式表示):___;
(3)请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是__,实验现象是_,化学方程式为__.
【答案】红 2NaOH+H2SO4=Na2SO4+2H2O 方案二 Na2SO4+BaCl2=BaSO4↓+2NaCl 锌粒或碳酸钠等 有气体放出 Zn+H2SO4=ZnSO4+H2↑(合理即可)
【解析】
(1)酚酞试液遇碱性溶液变红,所以向氢氧化钠溶液中滴入几滴酚酞试液后,溶液由无色变为红色,氢氧化钠与硫酸反应生成硫酸钠和水。故答案为:红;2NaOH+H2SO4=Na2SO4+2H2O;
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:表格中设计的实验方案中,正确的是方案二;另外一个实验方案错误的原因是:硫酸钠能与氯化钡反应生成硫酸钡白色沉淀和氯化钠;故答案为:方案二;Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)设计方案:我选择锌粒或碳酸钠,现象是有气体放出,证明硫酸过量;故答案为:锌粒或碳酸钠等;有气体放出;Zn+H2SO4=ZnSO4+H2↑;(合理即可)

 期末冲刺100分创新金卷完全试卷系列答案
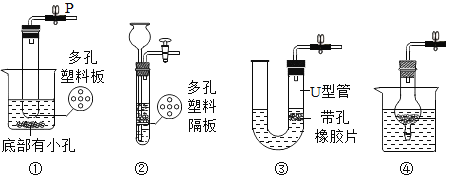
期末冲刺100分创新金卷完全试卷系列答案【题目】如图是实验室制取气体的常用装置,请根据图回答下列问题。
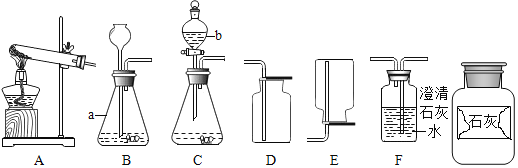
(1)写出图中标有序号的仪器名称:a______;b______。
(2)若使用装置A制取氧气,应______(填改进措施)方可继续实验,其化学方程式是______。
(3)某广口瓶上的标签已破损,只剩下“石灰”两个字,已知该样品未变质。某兴趣小组设计实验探究该药品的成分,请完成以下实验报告。
实验步骤 | 实验现象 | 结论 |
取少量瓶中的固体于烧杯中,加入适量水,并感知烧杯壁的温度 | ______ | 固体不是生石灰 |
取上述烧杯中的少量上层清液于试管中,滴加酚酞试液 | 无明显现象 | 固体不是熟石灰 |
取少量瓶中的固体于装置B中,加入适量稀盐酸 | 产生大量气泡,装置F中的澄清石灰水变浑浊 | F中涉及化学方程式为 ______ |
(4)确定药品的成分后,兴趣小组选用了图中的______(填序号),可实现控制反应的发生与停止。