题目内容
【题目】下表为侯氏制碱法中部分物质的溶解度。
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度 | NH4Cl | 33.2 | 37.2 | 41.4 | 45.8 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | |
(1)在表内温度范围内溶解度随温度变化最小的是_____。
(2)在侯氏制碱法的某一个工艺流程中,溶液中只有表中三种物质,在相同的温度下首先析出的物质是_____(填化学式):如果要使混有少量氯化钠的氯化铵溶液析出氯化铵可采用的方法是_____。
(3)40℃时将一定质量的氯化铵溶液按图进行操作:
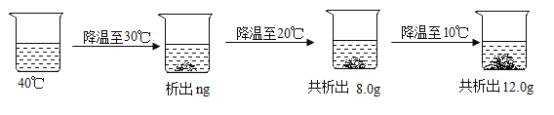
40℃时该氯化铵溶液是__________(填“饱和”或“不饱和”)溶液;图中的n的数值是___________。
【答案】NaCl NaHCO3 降温结晶(或冷却结晶) 不饱和 3.8
【解析】
(1)根据题中表格提供的数据,在表内温度范围内,NH4Cl的溶解度从33.2g增大到45.8g,NaCl的溶解度从35.8g增大到36.6g,NaHCO3的溶解度从8.2g增大到12.7g,因此随温度变化最小的是:NaCl。
(2)在侯氏制碱法的某一工艺流程中,溶液中的三种物质NaCl、NH4Cl、NaHCO3在相同的温度下,NaHCO3的溶解度最小,所以首先析出的物质是:NaHCO3;因为NaCl的溶解度随温度变化较小,NH4Cl的溶解度随温度升高增大且相对较大,所以如果要使混有少量氯化钠的氯化铵溶液析出氯化铵晶体可采用的方法是:降温结晶(或冷却结晶)。
(3)根据图示,从20℃降温至10℃,烧杯中析出晶体质量为:12.0g-8.0g=4.0g,而氯化铵从20℃降温至10℃,溶解度由37.2g变为33.2g,减小4g,据此可以确定烧杯中溶剂水的质量为100g,因为40℃降温至30℃,烧杯内析出晶体质量为ng,此时烧杯内溶液为30℃的饱和溶液,根据溶剂水的质量为100g,可以推出30℃降温至20℃时,析出的晶体质量为:41.4g-37.2g=4.2g,因此8.0g-ng=4.2g,解得n=3.8。根据40℃和30℃时氯化铵的溶解度差值:45.8g-41.4g=4.4g,因为溶液中溶剂水的质量为100g,所以40℃时如果该氯化铵溶液为饱和溶液,降温至30℃应该析出4.4g晶体,而40℃时该氯化铵溶液降温至30℃只能析出晶体3.8g,因此40℃时该氯化铵溶液是不饱和溶液。

【题目】合肥郊区的农民将农作物秸秆粉碎后放在密闭的沼气池内发酵制沼气,发酵后的残余物可作肥料,沼气是一种清洁燃料,其主要成分是甲烷(CH4)。化学小组的同学围绕“秸秆主要由哪些元素组成”这一问题展开了以下探究活动。
(猜想与假设)秸秆中一定含有碳元素、氢元素和氧元素。
探究步骤 | 实验现象 | 相关结论 |
用坩埚钳夹持一小段干燥的秸秆,点燃后伸入盛有氧气的集气瓶中 | 秸秆剧烈燃烧,火焰熄灭后观察到瓶壁_____ | 产物中有H2O |
再向集气瓶中滴入少量_____ | 观察到有白色沉淀物 | 产物中有CO2 |
(结论与解释)依据化学反应前后元素的种类不变,同学们得出秸秆中含有C、H、O三种元素的结论。
(反思与评价)你认为同学们得出的结论是否正确并说明理由:__。
(拓展与应用)农村传统的处理秸秆方式是直接烧掉,试从环境、原料利用等方面说明将农作物秸秆制成沼气的重要意义是:___。写出甲烷在足量氧气中燃烧的化学方程式___。
【题目】根据如表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)20℃时,溶解度最大的物质是_____.
(2)60℃时,100g水中最多溶解NaCl_____g.
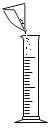
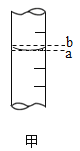
(3)量筒的局部示意图如图甲所示,量取时应沿_____(选填“a”或“b”)视线进行读数.
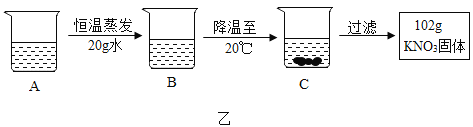
(4)A是80℃含有120g水的KNO3溶液.经过图乙操作,得到102gKNO3固体.
①A溶液为_____(选填“饱和”或“不饱和”)溶液;
②对以上过程的分析,正确的是_____(选填字母).
a A到B的过程中,溶液中溶质的质量没有改变
b B中溶质与溶剂的质量比为169:100
c A溶液的质量等于222g
d 开始析出KNO3固体的温度在60℃至80℃之间
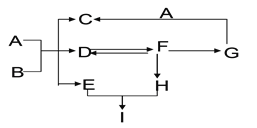
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | ______________ | ______________________________ |
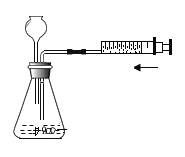
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是______________(填序号).
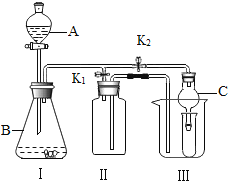
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______________________________;她的改进措施是_______________________________________________________.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________,可以观察到的现象是________________________________________.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是____________(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为_______g.
③过滤、蒸发时都需用到的仪器是__________(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________________.