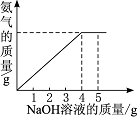
题目内容
| |||||
答案:(1)1:7:12
(2)解:设2.0g样品中含NH4NO3的质量为ⅹ,反应生成NaNO3的质量为y ,反应生成的NH3的质量为z,
NH4NO3 + NaOH = NaNO3+ NH3↑+ H2O
80 40 85 17
ⅹ 4g×20% y z
ⅹ=1.6g
y=1.7g
z=3.4g
样品中NH4NO3的质量分数为:
(3)反应后所得溶液中NaNO3的质量分数为:
(2)解:设2.0g样品中含NH4NO3的质量为ⅹ,反应生成NaNO3的质量为y ,反应生成的NH3的质量为z,
NH4NO3 + NaOH = NaNO3+ NH3↑+ H2O
80 40 85 17
ⅹ 4g×20% y z
ⅹ=1.6g
y=1.7g
z=3.4g
样品中NH4NO3的质量分数为:

(3)反应后所得溶液中NaNO3的质量分数为:


练习册系列答案
相关题目
| |||||||||||||||
| |||||
下列“水”属于纯净物的是 ( )
| A.医用的生理盐水 | B.矿泉水 | C.蒸馏水 | D.海水 |
下列变化中没有生成新物质的是( )。
| A.酒精挥发 | B.煤气爆炸 | C.烟花燃放 | D.白磷自燃 |
理科课程的目标是提高学生的科学素养,从而满足学生终身学习和发展的需求。你认为下列观点不正确的是
| A.元素、单质、纯净物都是宏观范畴,分子、原子、离子是微观范畴 |
| B.世界是物质的,物质都是看的见、摸的着的 |
| C.树立珍惜资源、爱护环境、合理使用化学物质的观念 |
| D.物质的结构决定性质,性质决定用途;反之用途反映性质,性质反映结构 |
下列各组物质中,前者属于化合物,后者属于混合物的是
| A.冰水、糖水 | B.食盐水、氧化镁 |
| C.液氧、过氧化氢溶液 | D.洁净的空气、四氧化三铁 |