题目内容
【题目】在化学实验室,小建同学发现用石灰石和稀盐酸制取二氧化碳的锥形瓶中有残留的白色固体,成分为未反应的碳酸钙、杂质(不溶于水也不参与反应)和氯化钙的混合物。小设同学想测定石灰石中碳酸钙的含量并配制一种溶液,实验及数据如下(实验中所得的溶液都为不饱和溶液):

(1)请写出发生反应的化学方程式_______________;
(2)利用已知条件列出与5g碳酸钙反应的物质质量(x)的比例式__________;
(3)石灰石中碳酸钙的含量为___________;
(4)实验所用稀盐酸中溶质的质量分数为__________;
(5)若将滤液A蒸发16.7g水后,所得溶液的溶质质量分数为_____________;
(6)配制上述实验所用稀盐酸,需要36.5%的浓盐酸与水的质量比为_____________。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ ![]() 75% 7.3% 22.2% 1∶4
75% 7.3% 22.2% 1∶4
【解析】
(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)设与5g碳酸钙反应的稀盐酸溶液溶质的质量为x
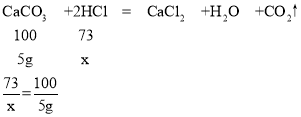
故填:![]()
(3)由质量守恒定律可知,生成二氧化碳的质量为:21.1g+100g-5g-113.9g=2.2g;
设白色固体中碳酸钙的质量为y,
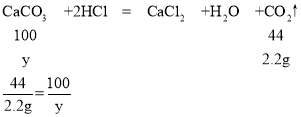
y=5g
则白色固体中氯化钙的质量为21.1g-5g-5g=11.1g
原石灰石中碳酸钙的质量为: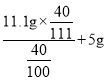 =15g
=15g
原石灰石中碳酸钙的质量分数为:![]() =75%
=75%
答:原石灰石中碳酸钙的质量分数为75%;
故填:75%;
(4)设加入5g碳酸钙后生成二氧化碳的质量为z;
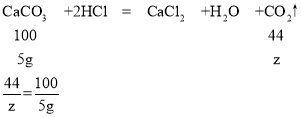
z=2.2g
所以100g稀盐酸参加反应,生成二氧化碳的总质量为2.2g+2.2g=4.4g
设实验所用稀盐酸中溶质的质量分数为a,生成氯化钙的质量为b,

a=7.3%
b=11.1g
答:实验所用稀盐酸中溶质的质量分数为7.3%。
故填:7.3%;
(5)若将滤液A蒸发16.7g水后,所得溶液的溶质质量分数为:![]()
故填:22.2%;
(6)设配制上述实验100g 7.3%稀盐酸,需要36.5%的浓盐酸的质量为c,则
100g×7.3%=c×36.5%
c=20g
需要加水的质量为100g-20g=80g
故需要36.5%的浓盐酸与水的质量比为:20g:80g=1:4
故填:1:4。

【题目】碳酸氢铵(NH4HCO3),俗称“碳铵”,是农村常用的氮肥。NH4HCO3可溶于水:受热容易分解,生成三种物质,经检测,这三种物质性质如下:
生成物 | 相关性质 |
生成物(一) | 无色无味的液体,常用作溶剂 |
生成物(二) | 能使澄清石灰水变浑浊的气体。 |
生成物(三) | 有刺激性气味的气体,水溶液呈碱性。 |
(1)请写出碳酸氢铵受热分解的化学方程式:_____。
(2)请预测碳酸氢铵的化学性质,说明预测的依据,并设计实验验证。
限选试剂是:碳酸氢铵粉末、熟石灰、食盐、稀硫酸、紫色石蕊溶液、炭粉、镁条、氧化铜。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸类反应 | 碳酸氢铵组成里有碳酸氢根离子 | 取少量碳酸氢铵粉末于试管中,加入足量的_____,如果观察到_____,则预测成立。 |
②能够与_____(填物质类别)反应 | _____ | 取少量碳酸氢铵粉末_____。如果_____,则预测成立。 |