题目内容
某纯净气体通过下图装置时,可观察到:A中紫色石蕊试液不变色,C中澄清石灰水变浑浊。据此判断:气体和黑色粉末可能的组合是什么?
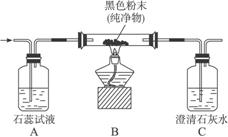
思路解析:本题是由实验现象探讨物质组成的题目,有一定的开放性。实验过程中,A中紫色石蕊试液不变色,说明该气体既不是酸性气体(CO2、HCl、SO2 ……),也不是碱性气体(NH3)。C中澄清石灰水变浑浊,说明经过B装置反应后有CO2气体生成。已知通入的气体和B中玻璃管内盛的黑色粉末都是纯净物,说明玻璃管中盛的不是炭粉跟氧化铜的混合物。根据已有知识可确定气体和黑色粉末的可能组成是:氧气和炭粉或一氧化碳和氧化铜粉末。
……),也不是碱性气体(NH3)。C中澄清石灰水变浑浊,说明经过B装置反应后有CO2气体生成。已知通入的气体和B中玻璃管内盛的黑色粉末都是纯净物,说明玻璃管中盛的不是炭粉跟氧化铜的混合物。根据已有知识可确定气体和黑色粉末的可能组成是:氧气和炭粉或一氧化碳和氧化铜粉末。
答案:氧气和炭粉或一氧化碳和氧化铜粉末。

练习册系列答案
相关题目


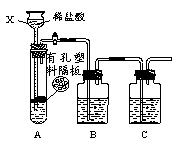
 2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
 2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。
2Cu +CO2↑ 的反应外,还可能发生的化学反应方程式: 。