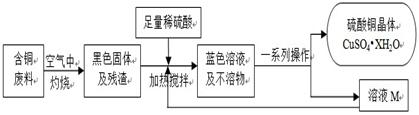
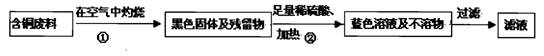
题目内容
胆矾(CuSO4·5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4·5H2O的新工艺.模拟制备装置如下图所示,根据题意回答下列问题.

(1)如图装置中,分液漏斗内装的液体是________(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO2+2NaOH![]() 2NaNO2(该物质化学名是________)+H2O.该装置中搅拌器的作用是________.反应所得产品在________(填“三颈烧瓶”或“锥形瓶”)中.
2NaNO2(该物质化学名是________)+H2O.该装置中搅拌器的作用是________.反应所得产品在________(填“三颈烧瓶”或“锥形瓶”)中.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中常常含有的杂质是一种硝酸盐,其化学式是________,已知10℃、20℃时有关物质的溶解度为:CuSO4·5H2O(17.4 g、20.7 g);该硝酸盐(95.3 g、125.1 g),提纯CuSO4·5H2O的实验操作是________.
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是________,检验该气体的实验操作是________.
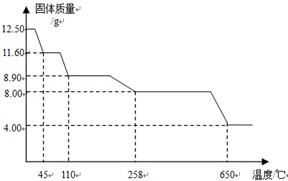
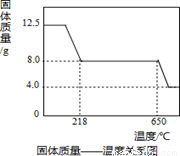
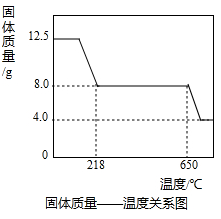
(4)将0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.

①由图中可以看出,CuSO4·5H2O分解的最低温度是________.
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4·5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为________.
答案:(1)浓硝酸 亚硝酸钠 充分接触,加快反应速度 三颈烧瓶
(2)Cu(NO3)2 重结晶(或冷却结晶);
(3)铜离子作催化剂,双氧水分解出氧气;用带火星木条检验,看是否复燃.
(4)①102℃; ②CuSO4˙H2O;③CuSO4˙5H2O
CuO+SO3↑+5H2O↑; △
(1)由生成的物质有气体NO、NO2等可推断加入的物质是浓硝酸,依据盐的化学式读法可知NaNO2可知其化学名称为亚硝酸钠,在反应中搅拌器在反应时的作用是充分接触,加快反应速率,依据叙述可知所得的产品存在的装置应该是在三颈烧瓶中;
(2)因为铜与浓硝酸也可以反应生成硝酸铜,所以制取的硫酸铜晶体中常含有硝酸铜的杂质;因为硫酸铜晶体的溶解度随温度变化不明显,而硝酸铜的溶解度随温度变化很明显,所以采用重结晶法可提纯硫酸铜晶体;
(3)因为双氧水可以分解生成氧气,所以可猜想是铜离子起到了催化作用使双氧水分解生成了氧气,在检验是否是氧气时一般是采用带火星的木条看是否复燃完成;
(4)①由图象中的信息可知CuSO4?5H2O样品受热脱水过程中在102℃物质的质量开始变小,所以硫酸铜晶体分解的最低温度是102℃;
②解:设238℃时晶体化学式是CuSO4˙xH2O
CuSO4?5H2O
| ||
250 160+18x
0.800g 0.570g
| 250 |
| 160+18x |
| 0.800g |
| 0.570g |
x=1
该晶体化学式是CuSO4˙H2O.
③依据题中的信息可知产物是氧化铜、三氧化硫和水,所以化学方程式为:CuSO4˙5H2O
| ||

 阅读快车系列答案
阅读快车系列答案