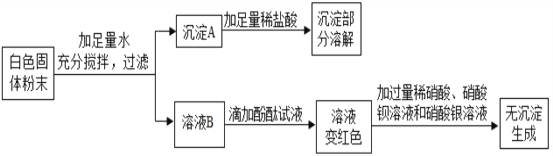
题目内容
【题目】定量研究是科学研究的重要方法之一,利用它可以解决许多生产生活中的实际问题。
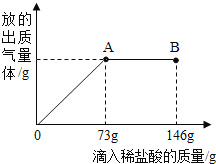
⑴将20g质量分数为4%的氢氧化钠溶液与7.3g稀盐酸混合,恰好完全反应,所得溶液的PH为7,试计算所用稀盐酸的溶质质量分数。
⑵实验室浓盐酸(分析纯)的溶质质量分数在36%-38%之间为合格药品。(1)题中的稀盐酸是用一定体积(折算成质量为2g)的浓盐酸(分析纯)加水配制而成的。通过计算判断该浓盐酸是否为合格药品。(只写结果,不写计算过程)
【答案】(1)10%;(2)浓盐酸的质量分数为36.5% ,该浓盐酸为合格药品
【解析】(1)20g质量分数为4%的氢氧化钠溶液中氢氧化钠的质量为:20g×4%=0.8g,设稀盐酸中HCl的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
0.8g ![]()
![]() ,解得:
,解得: ![]() =0.73g,稀盐酸的溶质的质量分数为:
=0.73g,稀盐酸的溶质的质量分数为: ![]() ;(2)设该浓盐酸的质量分数为y
;(2)设该浓盐酸的质量分数为y
2g×y=0.73g,解得:y=36.5%,36%<36.5%<38%,所以该浓盐酸为合格药品。
答:(1)所用稀盐酸溶质质量分数为10%;(2)该浓盐酸为合格药品。

 寒假乐园北京教育出版社系列答案
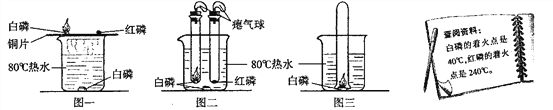
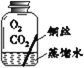
寒假乐园北京教育出版社系列答案【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
【查阅资料】① 铜锈受热易分解 ② 硫酸铜粉末遇水由白色变为蓝色
【进行实验】 小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
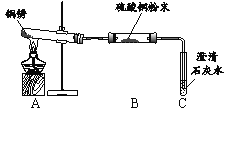
【解释与结论】(1)C中反应的化学方程式是______。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和______。
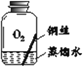
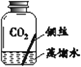
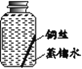
II.探究铜生锈的条件
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
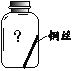
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
【解释与结论】
(3)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是______。
(4)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是______(填编号)。
(5)对比实验②和③,得出的结论是______。
(6)为验证猜想,请在图中将实验⑤补充完整。______
(7)由上述实验可推知,铜生锈的条件是______。
【反思与应用】
(8)结合上述实验,你对保存铜制品的建议是______。
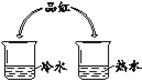
【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A | B |
|
|
从微粒角度解释: (1)品红在水中扩散的原因是______。 (2)品红在热水中扩散速度快,其原因是______。 | (1)实验现象是______。 (2)实验结论是______。 |