题目内容
【题目】如图是某食品包装中的干燥剂。

下面是兴趣小组对干燥剂的探究过程,请参与到其中去,回答下列有关问题:
(1)干燥剂能吸水的原因是_____(用化学方程式表示)。
(2)同学们对放置一段时间干燥剂的成分进行探究
(提出问题)干燥剂现在的成分是什么?
(猜想)猜想1:含有CaO 猜想2:含有Ca(OH)2 猜想3:含有CaCO3
(进行实验)
实验步骤 | 实验现象 | 结论 |
1.取少量干燥剂于试管中,向试管中加入少量的水,用手触摸试管外壁 | 试管外壁有热感 | 含有_____ |
2.向步骤1加水后的试管中滴入无色酚酞试液 | 无色酚酞试液变红色 | 含有Ca(OH)2 |
3.向步骤2反应后的试管中加入足量的______ | _____ | 含有CaCO3,反应的化学方程式是______ |
(实验分析)小明同学认为步骤2不能确定Ca(OH)2是否存在,原因是_____。
(改进实验)小明同学进行下列实验
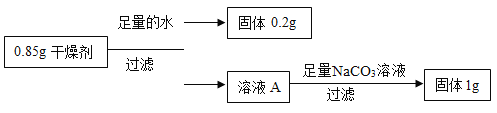
根据小明的实验结果,干燥剂中含有的物质是_____。
【答案】CaO+H2O=Ca(OH)2 氧化钙 稀盐酸 产生气泡 CaCO3+2HCl=CaCl2+H2O+CO2↑ 氧化钙与水反应也产生氢氧化钙 CaO、Ca(OH)2和CaCO3
【解析】
(1)干燥剂能吸水的原因:氧化钙和水反应生成氢氧化钙,反应的化学方程式:CaO+H2O=Ca(OH)2。
故填:CaO+H2O=Ca(OH)2。
(2)[进行实验]
1.取少量干燥剂于试管中,向试管中加入少量的水,用手触摸试管外壁,试管外壁有热感,是因为氧化钙和水反应放热,说明干燥剂中含有氧化钙;
2.向步骤1加水后的试管中滴入无色酚酞试液,无色酚酞试液变红色,说明溶液显碱性;
3.向步骤2反应后的试管中加入足量稀盐酸,产生气泡,是因为碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑,实验过程如下所示:
实验步骤 | 实验现象 | 结论 |
1.取少量干燥剂于试管中,向试管中加入少量的水,用手触摸试管外壁 | 试管外壁有热感 | 含有氧化钙 |
2.向步骤1加水后的试管中滴入无色酚酞试液 | 无色酚酞试液变红色 | 含有Ca(OH)2 |
3.向步骤2反应后的试管中加入足量稀盐酸 | 产生气泡 | 含有CaCO3,反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑ |
[实验分析]
小明同学认为步骤2不能确定Ca(OH)2是否存在,原因是氧化钙与水反应也产生氢氧化钙。
故填:氧化钙与水反应也产生氢氧化钙。
[改进实验]
加入足量水后得到0.2g固体,说明干燥剂中含有0.2g碳酸钙,则干燥剂中其它物质质量:0.85g﹣0.2g=0.65g;
如果干燥剂中除去碳酸钙外只有氧化钙,则氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式及其质量关系为:
CaO+H2O=Ca(OH)2,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,

而得到固体质量是1g,说明除去碳酸钙外不只含有氧化钙,即干燥剂中含有碳酸钙、氧化钙和氢氧化钙。
故填:CaO、Ca(OH)2和CaCO3。

 小学课时特训系列答案
小学课时特训系列答案