题目内容
在化工生产中,原料往往不能全部转化为产品.工业上常用电解纯净的饱和食盐水的方法来制得烧碱溶液,再经过浓缩、蒸发等步骤,最后得到固体烧碱.请推测在空气中放置一段时间的烧碱样品中,可能含有的杂质是:________.
NaCl、Na2CO3
分析:利用饱和食盐水的制氢氧化钠时可能有剩余的氯化钠,在空气中放置一段时间,与二氧化碳发生反应,来解答该题
解答:在制取氢氧化钠过程中,可能有剩余的氯化钠,而氢氧化钠可以和二氧化碳反应,所以放置一段时间后还可能存在与二氧化碳反应生成的碳酸钠.
故答案为:NaCl、Na2CO3.
点评:熟练掌握氢氧化钠的化学性质,能够根据题给信息分析出所需要的对解题有帮助的信息是我们必须具备的能力.
分析:利用饱和食盐水的制氢氧化钠时可能有剩余的氯化钠,在空气中放置一段时间,与二氧化碳发生反应,来解答该题
解答:在制取氢氧化钠过程中,可能有剩余的氯化钠,而氢氧化钠可以和二氧化碳反应,所以放置一段时间后还可能存在与二氧化碳反应生成的碳酸钠.
故答案为:NaCl、Na2CO3.
点评:熟练掌握氢氧化钠的化学性质,能够根据题给信息分析出所需要的对解题有帮助的信息是我们必须具备的能力.

练习册系列答案
相关题目
 在化工生产中,原料往往不能全部转化成产品.某校学生对买来的工业固体烧碱的杂质成分进行研究,他们查阅资料得知:在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).他们推测该工业固体烧碱中可能含有碳酸钠、氯化钠,并设计了实验来验证假设.
在化工生产中,原料往往不能全部转化成产品.某校学生对买来的工业固体烧碱的杂质成分进行研究,他们查阅资料得知:在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).他们推测该工业固体烧碱中可能含有碳酸钠、氯化钠,并设计了实验来验证假设.(1)请你帮助他们完成实验报告:
| 实验步骤 | 实验现象 | 结 论 |
| ①取样,加足量的水 | 固体完全溶解 | -- |
| ②用试管取上述试液,加入过量稀硝酸,塞上带导管的单孔塞;将导管的另一端插入 |
有 有 |
证明原固体烧碱中含有碳酸钠 |
| ③向试管中再加入硝酸银 | 有白色沉淀生成 | 证明原固体烧碱中含有 |
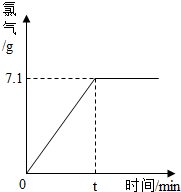
( 3 )现取100g室温下的饱和食盐水(此时质量分数约为26.5%)进行电解,当反应停止后,生成氯气的质量与时间的关系如图所示.请计算:参加反应的氯化钠的质量是多少?反应后所得烧碱溶液的质量分数是多少?(计算结果精确到0.001)

 (2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
(2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.