题目内容
【题目】下图为初中化学中常见气体的制备和性质实验,回答下列问题。
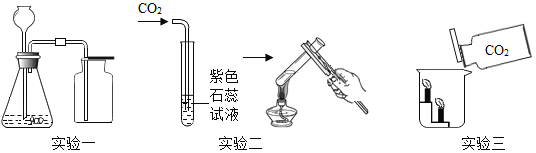
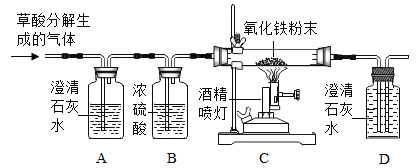
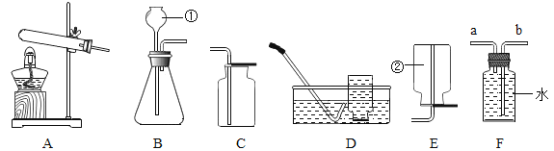
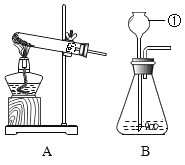
(1)实验一用于制取和收集O2,发生反应的化学方程式为_____________________。该装置能否用于制取和收集CO2______________ (填 “能”或“不能”)。
(2)实验二观察到溶液颜色的变化是_____________(填序号),实验中使石蕊变红的物质是_____________(填化学式) 。
A 紫色→红色→无色
B 紫色→红色→紫色
C 红色→紫色→紫色
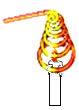
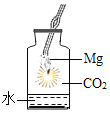
(3)实验三中灭火的原理是_____________________。
【答案】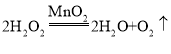 能 B H2CO3 二氧化碳密度比空气大,不能燃烧也不能支持燃烧
能 B H2CO3 二氧化碳密度比空气大,不能燃烧也不能支持燃烧
【解析】
(1)实验一中的发生装置为固液常温反应型,该套装置用于制取和收集O2,反应物是过氧化氢溶液,用二氧化锰做催化剂,生成物是水和氧气,反应的化学方程式为: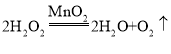 。因为实验室常用石灰石和稀盐酸反应制取二氧化碳,所以反应装置也属于固液常温反应型,同样因为二氧化碳密度比空气大,所以也可以采用向上排空气法收集,因此该套装置能用于制取和收集CO2。
。因为实验室常用石灰石和稀盐酸反应制取二氧化碳,所以反应装置也属于固液常温反应型,同样因为二氧化碳密度比空气大,所以也可以采用向上排空气法收集,因此该套装置能用于制取和收集CO2。
(2)因为二氧化碳溶于水生成碳酸,碳酸呈酸性,能使紫色石蕊溶液变红,所以二氧化碳通入紫色石蕊溶液,溶液由紫色变为红色;又因为碳酸不稳定,受热易分解,所以变红的溶液加热后,碳酸分解,溶液由红色变为紫色。因此实验二观察到溶液颜色的变化是:紫色→红色→紫色,选B。根据上述分析,实验中使石蕊变红的物质是碳酸,化学式是:H2CO3。
(3)实验三中可以观察到的现象是:烧杯内下面的一支蜡烛先熄灭,上面的一支蜡烛后熄灭,由此可见,实验三中二氧化碳灭火的原理是:二氧化碳密度比空气大,不能燃烧也不能支持燃烧。

 阅读快车系列答案
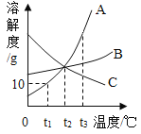
阅读快车系列答案【题目】如表为硝酸钾和氯化钠的部分溶解度数据,某同学进行了如下图所示的两个溶解实验。
物质/溶解度/g/温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
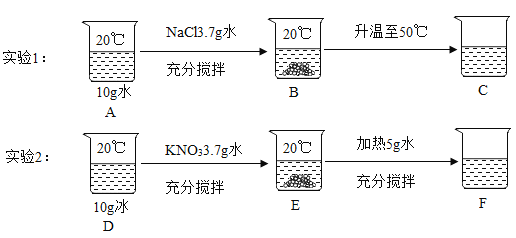
(1)由表格数据可知,溶解度随温度升高变化显著的物质是_____(选填“NaCl”或“KNO3”)。
(2)上述溶液中属于饱和溶液的是_____(填 A-F 序号)。
(3)BCEF 溶液中溶质质量分数由大到小的关系是_____(用“<”、“>”、“=”表示)
(4)关于图中有关说法不正确的是_____。
A B烧杯的溶液还可以溶解硝酸钾固体
B 将20℃时硝酸钾的不饱和溶液转化为饱和溶液的方法:蒸发溶剂或升高温度
C 氯化钠中混有少量的硝酸钾可以用蒸发结晶的方法除去