题目内容
【题目】向一定质量的硫酸钙固体中加入过量的氢氧化钡溶液,充分反应后过滤,得到滤液质量为108.5g,向滤液中加入21.2g碳酸钠粉末,恰好完全反应,过滤后称量滤液质量为100g,则硫酸钙固体的质量为( )
A.6.8gB.13.6gC.20.4gD.27.2g
【答案】B
【解析】
过程中涉及的个反应为:![]() 、
、![]() 、
、![]() 。
。
根据题意,108.5g滤液中含有氢氧化钙和氢氧化钡两种溶质,向滤液中加入21.2g碳酸钠粉末,恰好完全反应,过滤后称量滤液质量为100g,则反应中生成的碳酸钙和碳酸钡的质量总和为:108.5g+21.2g-100g=29.7g。
设与氢氧化钙反应的碳酸钠质量为x,则与氢氧化钡反应的碳酸钠质量为:21.2g- x;设反应生成的碳酸钙质量为y,则生成的碳酸钡质量为:29.7g-y;设硫酸钙固体的质量为z。
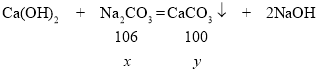
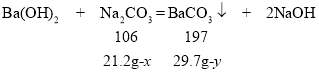
![]()
![]()
解得:y=10g
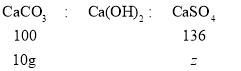
![]()
解得z=13.6g。故选B。

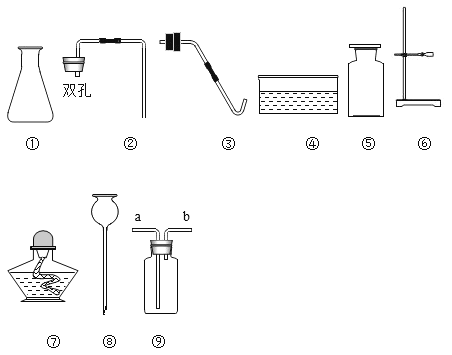
【题目】高阳同学通过阅读课外资料得知,潜水艇中常用过氧化钠(Na2O2)作为供氧剂,有关反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2H2O═4NaOH+O2↑。于是她用如图所的装置来制取CO2并验证其与Na2O2的反应。
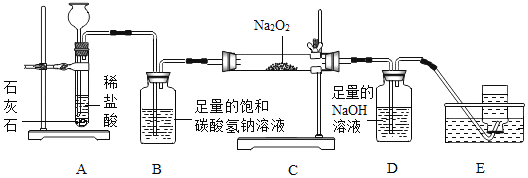
(1)装置B的作用是_____。
(2)反应一段时间后,装置E中收集到的气体主要是_____;反应后装置C硬质玻璃管中固体的成分是什么?高阳为此又进行了如下探究:
(猜想与假设)
猜想一 Na2CO3
猜想二Na2CO3和Na2O2
猜想三Na2CO3和NaOH
你认为还可能是_____
(设计实验)
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的水,振荡 | 固体完全溶解,_____ | 样品中一定没有Na2O2 |
②取少量实验①所得溶液于另一试管中,加入过量的BaCl2溶液,振荡 | 有白色沉淀产生 | 猜想三正确 |
③取少量实验②所得上层清液于另一试管中,加入_____溶液,振荡 | 有白色沉淀产生 |
(反思与评价)反应后装置C硬质玻璃管中的固体含有NaOH,原因可能是_____。