题目内容
(2013?如皋市模拟)根据下列装置图,回答有关问题:
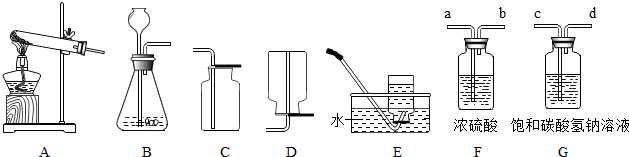
(1)①实验室用上图中A、C组合制取氧气,若选用KMnO4,则反应的化学方程式是
②如果做铁丝在氧气中燃烧的实验,最好用
(2)实验室通常利用上图中
①将制得的二氧化碳气体通入紫色石蕊溶液,你将观察到的现象是
A.a→b→c→d B.b→a→c→d C.c→d→a→b D.d→c→b→a
②检验二氧化碳的存在,可以将上图F装置中的浓硫酸换成

(1)①实验室用上图中A、C组合制取氧气,若选用KMnO4,则反应的化学方程式是
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,试管口要塞
| ||
棉花
棉花
,验满方法是将带火星的木条靠近集气瓶口,若木条复燃,证明已收集满氧气
将带火星的木条靠近集气瓶口,若木条复燃,证明已收集满氧气
.②如果做铁丝在氧气中燃烧的实验,最好用
E
E
装置收集氧气.(2)实验室通常利用上图中
BC
BC
装置的组合制取二氧化碳(选填字母),该反应的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
.①将制得的二氧化碳气体通入紫色石蕊溶液,你将观察到的现象是
紫色石蕊溶液变红
紫色石蕊溶液变红
,将变色后溶液加热至沸腾一段时间,发现液体始终未变色,可能的原因是使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体
使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体
.为了得到纯净、干燥的二氧化碳气体,除杂装置(如右图)的导管按气流方向连接顺序是C
C
(选填字母).A.a→b→c→d B.b→a→c→d C.c→d→a→b D.d→c→b→a
②检验二氧化碳的存在,可以将上图F装置中的浓硫酸换成
澄清石灰水
澄清石灰水
,该反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.分析:(1)根据高锰酸钾制取氧气的反应原理、注意事项、验满方法分析;根据排水法收集的氧气较纯分析;
(2)实验室是在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集;
①根据二氧化碳的性质结合实验注意事项分析;
根据实验的目的:得到纯净、干燥的二氧化碳气体,需要先除杂再干燥,进气口是长管;
②二氧化碳是用石灰水来检验的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水.
(2)实验室是在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集;
①根据二氧化碳的性质结合实验注意事项分析;
根据实验的目的:得到纯净、干燥的二氧化碳气体,需要先除杂再干燥,进气口是长管;
②二氧化碳是用石灰水来检验的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水.
解答:解:(1)①用加热高锰酸钾制取氧气的化学方程式是2KMnO4
K2MnO4+MnO2+O2↑;为防止高锰酸钾粉末进入导管,试管口要塞一团棉花;氧气的验满方法是将带火星的木条靠近集气瓶口,若木条复燃,证明已收集满氧气;
②做铁丝在氧气中燃烧的实验时,氧气的纯度要高,因此收集氧气时用排水法收集;
(2)实验室是在常温下用石灰石和稀盐酸来制取二氧化碳,发生装置应选B,二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集;石灰石和稀盐酸反应的化学方程式是CaCO3+2HCl═CaCl2+CO2↑+H2O;
①将制得的二氧化碳气体通入紫色石蕊溶液,紫色石蕊溶液变红;将变色后溶液加热至沸腾一段时间,发现液体始终未变色,可能的原因是使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体;
为了得到纯净、干燥的二氧化碳气体,需要先除杂再干燥,即先通过饱和的碳酸氢钠溶液除去杂质氯化氢,再通过浓硫酸吸水干燥,进气口是长管,故气流方向连接顺序是C;
②二氧化碳是用石灰水来检验的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;
故答案为:(1)①2KMnO4
K2MnO4+MnO2+O2↑;棉花;将带火星的木条靠近集气瓶口,若木条复燃,证明已收集满氧气;②E;
(2)BC;CaCO3+2HCl═CaCl2+CO2↑+H2O;
①紫色石蕊溶液变红;使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体;C;
②澄清石灰水;CO2+Ca(OH)2═CaCO3↓+H2O.
| ||
②做铁丝在氧气中燃烧的实验时,氧气的纯度要高,因此收集氧气时用排水法收集;
(2)实验室是在常温下用石灰石和稀盐酸来制取二氧化碳,发生装置应选B,二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集;石灰石和稀盐酸反应的化学方程式是CaCO3+2HCl═CaCl2+CO2↑+H2O;
①将制得的二氧化碳气体通入紫色石蕊溶液,紫色石蕊溶液变红;将变色后溶液加热至沸腾一段时间,发现液体始终未变色,可能的原因是使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体;
为了得到纯净、干燥的二氧化碳气体,需要先除杂再干燥,即先通过饱和的碳酸氢钠溶液除去杂质氯化氢,再通过浓硫酸吸水干燥,进气口是长管,故气流方向连接顺序是C;
②二氧化碳是用石灰水来检验的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;
故答案为:(1)①2KMnO4
| ||
(2)BC;CaCO3+2HCl═CaCl2+CO2↑+H2O;
①紫色石蕊溶液变红;使用较浓盐酸,在制得的二氧化碳气体中混入了氯化氢气体;C;
②澄清石灰水;CO2+Ca(OH)2═CaCO3↓+H2O.
点评:本考点主要考查氧气和二氧化碳的制取装置和收集装置的选择,同时也考查了氧气的验满方法、化学方程式的书写,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
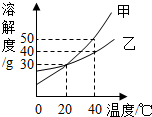 (2013?如皋市模拟)如图是甲、乙两种固体的溶解度曲线,下列说法中正确的是( )
(2013?如皋市模拟)如图是甲、乙两种固体的溶解度曲线,下列说法中正确的是( )
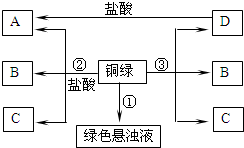 (2013?如皋市模拟)小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一层绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜[俗称铜绿,化学式为Cu2(OH)2CO3],该物质受热不稳定易分解.他根据元素守恒分析,得出铜生锈是铜与空气中的氧气、二氧化碳和
(2013?如皋市模拟)小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一层绿色物质,他想将其除掉.经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜[俗称铜绿,化学式为Cu2(OH)2CO3],该物质受热不稳定易分解.他根据元素守恒分析,得出铜生锈是铜与空气中的氧气、二氧化碳和