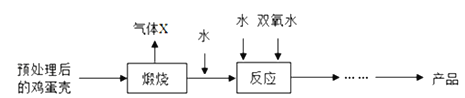
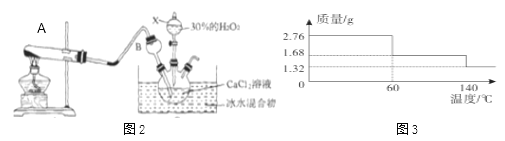
题目内容
【题目】某研究小组将打印机墨盒中的墨粉倒出,发现全部是黑色粉末,于是对墨粉的成分进行下列探究:
【提出猜想】该粉末可能含有炭粉、铁粉、氧化铁、四氧化三铁中的一种或几种。
(1)小明认为不可能含有氧化铁,原因是 __________________
【查阅资料】①四氧化三铁具有磁l生,能被磁铁吸引;
②金属氧化物能溶于稀酸。

______________
【进行实验】
(2)用化学方程式表示实验③中澄清石灰水变浑浊的原因________________。
【答案】 氧化铁的颜色为红棕色 
![]()
【解析】(1)根据氧化铁的颜色解答;【查阅资料】实验操作①根据铁和四氧化三铁能被磁铁吸引解答;②根据铁与稀硫酸反应有气体生成分析解答;③根据固体和液体分离是过滤操作解答;根据澄清石灰水变浑浊,说明有二氧化碳气体生成,进一步说明原混合物中含有碳解答;(2)根据二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水解答。(1)小明认为不可能含有氧化铁,原因是氧化铁的颜色为红棕色;【查阅资料】实验操作①铁和四氧化三铁能被磁铁吸引,说明粉末中可能含有铁和四氧化三铁(Fe、Fe3O4 );②铁与稀硫酸反应有气体生成。向试管中的黑色粉末中加入足量稀硫酸,固体部分溶解,无气泡产生,说明粉末中一定没有铁(Fe);③取②中反应后的物质,经过过滤、干燥及灼烧后,将内壁涂有澄清石灰水的小烧杯罩在上方,残渣完全消失,澄清石灰水变浑浊,说明燃烧生成了二氧化碳,故原粉末中一定含有碳(C)。(2) 二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目