题目内容
【题目】实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2)制备碱式碳酸铜的主要实验流程如下,已知:二氧化硅不溶于水,也不溶于酸. 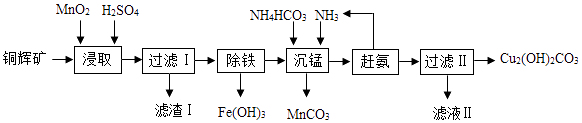
(1)浸取前辉铜矿粉碎成细颗粒,目的是;
(2)硫酸浸取时,Cu2S被MnO2氧化的化学方程式为2MnO2+Cu2S+4H2SO4═2MnSO4+2CuSO4+S+4 , 滤渣Ⅰ的成分为MnO2、单质S和(写化学式).
(3)浸取时,Fe2O3溶于硫酸反应的化学方程式为;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是;
(4)沉锰温度不宜过高,除了防止氨水挥发外,还能;
(5)“赶氨”时,最适宜的操作方法是 , 以减小氨气的溶解度.
(6)滤液Ⅱ中溶质主要是(NH4)2SO4 , 要得到其晶体可采用蒸发浓缩、、过滤晾干;
(7)经过滤得到的产品碱式碳酸铜需要洗涤、烘干,其中洗涤的方法是向盛有碱式碳酸铜固体的过滤器中加入 . (填字母序号)重复几次即可洗净; a.Na2CO3溶液 b.蒸馏水 c.稀盐酸.
【答案】
(1)增大接触面积,加快反应速率
(2)H2O;SiO2
(3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;铁离子在浸取时起催化作用
(4)防止NH4HCO3分解
(5)加热
(6)降温结晶
(7)b
【解析】解:(1)浸取前辉铜矿粉碎成细颗粒,目的是增大接触面积,加快反应速率.故填:增大接触面积,加快反应速率.(2)由2MnO2+Cu2S+4H2SO4═2MnSO4+2CuSO4+S+4可知,反应前后锰原子都是2个,铜原子都是2个,硫原子都是5个,而反应前氢原子是8个,反应后应该是8个,氧原子反应前是20个,反应后应该是20个,因此4后面应该是由2个氢原子和1个氧原子构成的物质,该物质是水,化学式是H2O;滤渣Ⅰ的成分为MnO2、单质S和没有反应的SiO2 . 故填:H2O;SiO2 . (3)浸取时,Fe2O3溶于硫酸生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O; 研究发现若先除铁再浸取,反应速率明显变慢,其可能原因是铁离子在浸取时起催化作用.故填:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;铁离子在浸取时起催化作用.(4)沉锰温度不宜过高,除了防止氨水挥发外,还能防止NH4HCO3分解.故填:防止NH4HCO3分解.(5)因为气体的溶解度随着温度升高而减小,因此“赶氨”时,最适宜的操作方法是加热,以减小氨气的溶解度.故填:加热.(6)滤液Ⅱ中溶质主要是(NH4)2SO4 , 得到其晶体可采用蒸发浓缩、降温结晶、过滤晾干.
故填:降温结晶.(7)因为碱式碳酸铜不溶于水,经过滤得到的产品碱式碳酸铜需要洗涤、烘干,其中洗涤的方法是向盛有碱式碳酸铜固体的过滤器中加入蒸馏水.故填:b.
【考点精析】本题主要考查了质量守恒定律及其应用和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;注意:a、配平 b、条件 c、箭号才能正确解答此题.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案