��Ŀ����
����Ŀ����װ�е���ˮ��A��B��C�ձ��зֱ����10 g��25 g��25 g NaNO3���壬����ܽ��������ͼһ��ʾ��
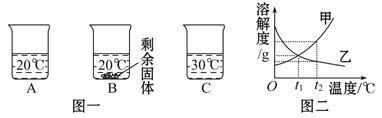
��1���ձ��е���Һһ�����ڱ�����Һ����___________(�����)��
��2��ͼ�����ܱ�ʾNaNO3�ܽ�����ߵ���___________(��ס����ҡ�)��
��3��ҪʹB�ձ���ʣ���������ܽ⣬�ɲ��õķ�����_________________��
��4����ͼ�����������ֱ�100 g�ס��ҵı�����Һ��t2 �潵�µ�t1 �棬��������Һ��������ȷ����______________(�����)��
A���ס��Ҷ��DZ�����Һ B�������ܼ���������<��
C����Һ��������>�� D������������������>��
���𰸡���1��B��2���ף�3����ˮ(������)��4��B��D
��������
�����������1���ж���Һ���͵ķ���������Һ���Ƿ���δ�ܽ�����ʣ����ձ��е���Һһ�����ڱ�����Һ����B����Ϊ��Һ����δ�ܽ������
��2�� ����ͼһ�����ձ�b��20��ʱ����Һ������30�棬���δ�ܽ������ȫ���ܽ⣬˵��NaNO3�ܽ�����¶����߶�����ͼ�����ܱ�ʾNaNO3�ܽ�����ߵ��Ǽ�
��3�� ����NaNO3�ܽ�����¶����߶�����ҪʹB�ձ���ʣ���������ܽ⣬�ɲ��õķ����ǣ���ˮ(������)
��4�� A�������ܽ�����ߣ��ҵ��ܽ�����¶����߶����ͣ��ʽ��ҵı�����Һ��t2 �潵�µ�t1 �棬�ұ�Ϊ��������Һ������B�����ڼס�����Һ�����¹�������Һ�е��ܼ��������䣬����t2 ��ʱ�����ܽ�ȴ����ҵ��ܽ�ȣ��ʵ������ļס��ҵı�����Һ�У�����Һ�����������������������������ܼ���������<�ң���ȷ��C�������ڽ��¹����У����о�������������û�У�����Һ��������<�ң�����D�������ܽ�����ߣ�����t1 ����ܽ��>t2 ��ʱ�ҵ��ܽ�ȣ��ʴ�t2 �潵�µ�t1 ��ʱ������������������>�ң���ȷ����ѡB��D

 53���ò�ϵ�д�
53���ò�ϵ�д�