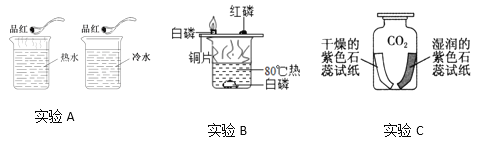
题目内容
【题目】在—密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:
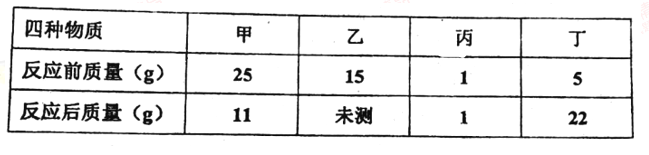
则下列表述正确的是( )
A. 未测值为3
B. 丙一定是催化剂
C. 乙全部发生了反应
D. 甲与乙反应的质量比为14:3
【答案】D
【解析】
根据表格可知,甲的质量反应减少了,所以甲是反应物,参加反应的甲的质量为:25g-11g=14g;丙的质量没有改变,所以可能没有参加反应,也可能是催化剂;丁的质量反应后增加了,是生成物,生成丁的质量为:22g-5g=17g;由质量守恒定律可知,乙是反应物,参加反应的乙的质量为:17g-14g=3g,未测值为:15g-3g=12g。
A、未测值=15g-3g=12g,故A错误;
B、丙的质量不变,不一定是催化剂,可能没有参与反应,故B错误;
C、乙是反应物,参加反应的乙的质量为:17g-14g=3g,未测值=15g-3g=12g,乙没有完全反应,故C错误;
D、甲与乙反应的质量比为:(25g-11g):(15g-12g)=14g:3g=14:3,故D正确。故选D。

【题目】过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
Ⅰ.不稳定性
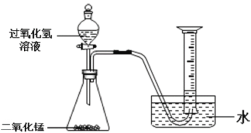
(1)如上图所示进行实验,过氧化氢分解的化学方程式为______。
(2)能用排水法收集O2的原因是______。
(3)探究温度对过氧化氢分解速率的影响。
同学们进行了如下的实验,实验数据如下表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度 % | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
反应时间 | 40 min | 40 min | 40 min |
由此得出的结论是______。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有腐蚀性。
(进行实验)
同学们用铜片设计实验验证H2O2溶液的腐蚀性。(各组实验中H2O2溶液和稀硫酸所用浓度均相同)
将铜片分别浸泡在3种溶液中进行实验,如下表。

(解释与结论)
(4)实验①的作用是______。
(5)能说明铜片被腐蚀与H2O2溶液和稀硫酸均有关的实验组是______。
(6)铜片被腐蚀的反应如下,补全该反应的化学方程式。Cu + H2O2+ H2SO4=== CuSO4 +□_______