题目内容
【题目】水是人们日常生活中非常熟悉的物质之一,我们应该多角度进行研究。

(一)水的组成——电解水
(1)电解一段时间后,将两极产生的气体的体积与时间的关系绘制成图②所示的平面直角坐标系,回答:
①由图①、②看出,A气体是__(填化学式),B气体在电源的___极。
②0~8min A、B气体的体积比为________。
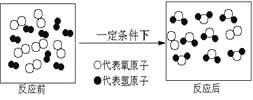
(2)微观该反应中发生分解的微粒是____。
(3)电解水的化学方程式为__________。
(二)水的净化
小刚收集到一瓶浑浊的长江水,他要模拟自来水厂的净水过程,最终制成自来水。其实验过程如图所示。请回答以下问题。

(4)操作①的名称是_________;该操作中用到的玻璃仪器有烧杯、玻璃棒和_______。
(5)操作②主要是除去水中的异味和色素,应选用的物质是_____。
(6)小刚发现经净化后的D是硬水,日常生活中常用___ 的方法使硬水软化。
(三)水的性质、变化和用途
(7)下列是有关水的性质、变化和用途的描述:
a.通常为无色、无味的液体
b.没有水,人和动物就无法生存
c.水是常用的灭火剂
d.氢气在氧气中能燃烧生成水
e.水可与氧化钙(CaO)反应生成氢氧化钙。
①其中属于水的物理性质的有________(填序号,下同);属于水的化学性质的有________;属于水的用途的有__________。
②写出上文描述中体现水的化学性质的化学方程式____。
【答案】H2 正极 2:1 水分子 2H2O![]() 2H2↑+O2↑ 过滤 漏斗 活性炭 煮沸 a e bc CaO+H2O=Ca(OH)2
2H2↑+O2↑ 过滤 漏斗 活性炭 煮沸 a e bc CaO+H2O=Ca(OH)2
【解析】
(1)①)①由图②看出,A气体是氢气,化学式为:H2;B气体是氧气,连接电源的正极;
② 0~8min A、B气体的体积比为2:1;
(2)水是由水分子构成的,所以该反应中发生分解的微粒是水分子;
(3)电解水生成氢气和氧气,反应的化学方程式为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)过滤是把不溶于液体的固体与液体分离的一种方法,经过操作①得到了固体和液体,故操作①是过滤;该操作中用到的玻璃仪器有玻璃棒、漏斗、烧杯等;
(5)活性炭具有吸附性,能吸附除去一些异味和色素;
(6)硬水给生活和生产带来很多麻烦,生活中常用煮沸的方法来降低水的硬度;
(7)①水通常为无色、无味的液体,不需要通过化学变化就能表现出来,均属于物理性质;水的化学性质是需要通过化学变化才能表现出来的性质,所以水可与氧化钙(CaO)反应生成氢氧化钙属于水的化学性质;水的用途:水水生命之源,所以没有水,人和动物就无法生存,水蒸发能吸热降温且附着在可燃物的表面,从而隔绝氧气,所以是常用的灭火剂;
②氧化钙(CaO)反应生成氢氧化钙,反应的化学方程式CaO+H2O=Ca(OH)2。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
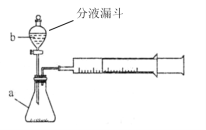
(1)下列方法能检查该装置气密性的是_______。
A.将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B.关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C.关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究_________对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如下图数据。
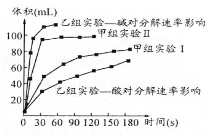
①甲组实验得出的数据可知:浓度越大,H2O2分解速率_________;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据相同条件下, H2O2在_______(填“酸”或“碱”)性环境下放出气体速率较快