题目内容
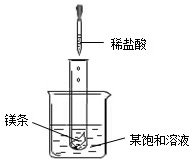
20、NaNO2(亚硝酸钠)、NaCl和物质M(不含结晶水)的溶解度曲线如左图所示,请根据图象和有关信息回答下列问题:
(1)t2℃时,NaNO2、NaCl和物质M的溶解度由大到小的顺序是
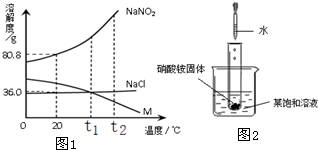
(2)如右图所示,当往试管中加入5mL稀盐酸时,试管内立刻产生大量气泡,同时放热使烧杯中饱和溶液变浑浊(不考虑水分蒸发).请判断该饱和溶液中溶质是NaNO2、NaCl和物质M中的
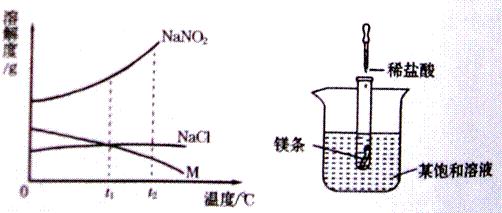
(3)分别将t2℃时NaNO2、NaCl和物质M的饱和溶液降温到t1℃,所得三种溶液中溶质的质量分数由大到小的顺序是
(1)t2℃时,NaNO2、NaCl和物质M的溶解度由大到小的顺序是
NaNO2>NaCl>M
.(2)如右图所示,当往试管中加入5mL稀盐酸时,试管内立刻产生大量气泡,同时放热使烧杯中饱和溶液变浑浊(不考虑水分蒸发).请判断该饱和溶液中溶质是NaNO2、NaCl和物质M中的
M
.
(3)分别将t2℃时NaNO2、NaCl和物质M的饱和溶液降温到t1℃,所得三种溶液中溶质的质量分数由大到小的顺序是
NaNO2>NaCl>M
.分析:根据固体物质的溶解度曲线可以:①比较不同的物质在同一温度下的溶解度大小,②判断物质的溶解度随温度变化的变化情况,如:亚硝酸钠的溶解度随温度的升高而增大,M的溶解度随温度的升高而减小等;某温度下物质的饱和溶液中溶质的质量分数的大小和同温度下的溶解度有很大的关系:饱和溶液中溶质的质量分数=$\frac{溶解度}{100+溶解度}$×100%.
解答:解:(1)由三物质的溶解度曲线可知,在t2℃时,三物质的溶解度大小关系是NaNO2>NaCl>M,故答案为:NaNO2>NaCl>M
(2)由题意可知,升温时该物质的饱和溶液中出现浑浊,说明该物质的溶解度随温度的升高而减小,故答案为:M
(3)在t2℃时,三物质的溶解度大小关系为:NaNO2>NaCl>M,因此三物质的饱和溶液中溶质的质量分数大小关系为:NaNO2>NaCl>M,当降温至t1℃时,由于NaNO2和NaCl的溶解度随温度的降低而减小,因此它们的饱和溶液中就会有晶体析出,但溶液仍旧是饱和溶液,由于在t1℃时,NaNO2比NaCl的溶解度大,因此降温以后的溶液中溶质的质量分数大小关系是NaNO2>NaCl;但由于M的溶解度随温度的降低而增大,因此降温时,M的饱和溶液就会变成不饱和溶液,但溶质的质量分数不变,虽然在t1℃时,NaCl和M的溶解度相等,但由于M已是不饱和溶液,因此溶液中溶质的质量分数大小关系是NaCl>M,故答案为:NaNO2>NaCl>M
(2)由题意可知,升温时该物质的饱和溶液中出现浑浊,说明该物质的溶解度随温度的升高而减小,故答案为:M
(3)在t2℃时,三物质的溶解度大小关系为:NaNO2>NaCl>M,因此三物质的饱和溶液中溶质的质量分数大小关系为:NaNO2>NaCl>M,当降温至t1℃时,由于NaNO2和NaCl的溶解度随温度的降低而减小,因此它们的饱和溶液中就会有晶体析出,但溶液仍旧是饱和溶液,由于在t1℃时,NaNO2比NaCl的溶解度大,因此降温以后的溶液中溶质的质量分数大小关系是NaNO2>NaCl;但由于M的溶解度随温度的降低而增大,因此降温时,M的饱和溶液就会变成不饱和溶液,但溶质的质量分数不变,虽然在t1℃时,NaCl和M的溶解度相等,但由于M已是不饱和溶液,因此溶液中溶质的质量分数大小关系是NaCl>M,故答案为:NaNO2>NaCl>M
点评:本题难度不是很大,主要考查了根据固体的溶解度曲线解决相关的问题,培养学生分析问题、解决问题的能力.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
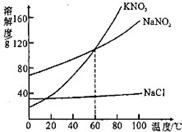 (1)KNO3、NaNO2、NaCl三种物质的溶解度受温度的影响最大的是
(1)KNO3、NaNO2、NaCl三种物质的溶解度受温度的影响最大的是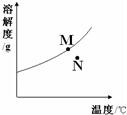 转化的是(A从溶液中析出时不带结晶水) (
转化的是(A从溶液中析出时不带结晶水) ( (2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题:
(2009?连云港) NaNO2(亚硝酸钠)、NaCl和物质M (不含结晶水)的溶解度曲线如图所示,请根据图象和有关信息回答下列问题: