题目内容
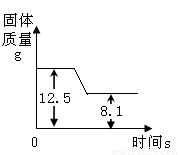
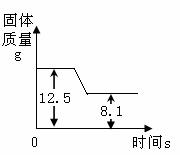
 煅烧石灰石方法可用于测定石灰石中CaCO3含量.如图是某种石灰石煅烧过程中质量的变化曲线图.(假设杂质受热不分解).(写出计算过程)
煅烧石灰石方法可用于测定石灰石中CaCO3含量.如图是某种石灰石煅烧过程中质量的变化曲线图.(假设杂质受热不分解).(写出计算过程)①写出石灰石分解的化学方程式
②该石灰石中CaCO3的物质的量是
③该石灰石中CaCO3质量分数是
分析:①碳酸钙分解能生成氧化钙和二氧化碳;
②碳酸钙的摩尔质量是100g/mol,根据碳酸钙的质量可以计算其物质的量;
③求出石灰石中碳酸钙的质量,则可以计算碳酸钙的质量分数.
②碳酸钙的摩尔质量是100g/mol,根据碳酸钙的质量可以计算其物质的量;
③求出石灰石中碳酸钙的质量,则可以计算碳酸钙的质量分数.
解答:解:①石灰石的主要成分是碳酸钙,煅烧石灰石时,碳酸钙受热分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3
CaO+CO2↑.
故填:CaCO3
CaO+CO2↑.
②由图中信息可知,完全反应后,固体质量减少了:12.5g-8.1g=4.4g,即反应生成了4.4g二氧化碳,
设碳酸钙的质量为x,
CaCO3
CaO+CO2↑,
100 44
x 4.4g
=
,
x=10g,
该石灰石中CaCO3的物质的量为:
=0.1mol.
故填:0.1;
③该石灰石中CaCO3质量分数为:
×100%=80%,
故填:80%.
| ||
故填:CaCO3
| ||
②由图中信息可知,完全反应后,固体质量减少了:12.5g-8.1g=4.4g,即反应生成了4.4g二氧化碳,
设碳酸钙的质量为x,
CaCO3
| ||
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
x=10g,
该石灰石中CaCO3的物质的量为:
| 10g |
| 100g/mol |
故填:0.1;
③该石灰石中CaCO3质量分数为:
| 10g |
| 12.5g |
故填:80%.
点评:本题考查化学方程式的书写、求物质的量、计算的方面的知识,比较简单,在求碳酸钙的物质的量时,要注意单位的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目