题目内容
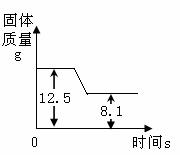
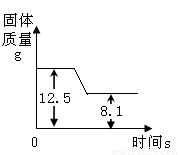
煅烧石灰石方法可用于测定石灰石中CaCO3 含量。右图是某种石灰石煅烧过程中质量的变化曲线图。(假设杂质受热不分解)。(写出计算过程)
(1)写出石灰石分解的化学方程式 。
(2)该石灰石中CaCO3的物质的量是 mol。
(3)该石灰石中CaCO3 质量分数是 。
【答案】
(1)CaCO3 CaO+CO2↑
CaO+CO2↑
(2)0.1mol
(3)80%
【解析】
试题分析:物质的量等于质量除以摩尔质量,由图依据质量守恒定律化学反应前后物质的总质量不变,则减少的质量为反应生成的二氧化碳的质量,即二氧化碳的质量=12.5-8.1 ;利用化学方程式中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量。
(1)石灰石分解生成氧化钙和二氧化碳:CaCO3 CaO+CO2↑
CaO+CO2↑
(2)解:设CaCO3的物质的量为xmol
nco2=(12.5-8.1)/44=0.1mol mol
CaCO3 CaO+CO2↑
CaO+CO2↑
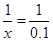
x=0.1(mol)
(3)m caco3=0.1×100=10(g)
 ×100%=80%
×100%=80%
考点:根据化学反应方程式的计算

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
 煅烧石灰石方法可用于测定石灰石中CaCO3含量.如图是某种石灰石煅烧过程中质量的变化曲线图.(假设杂质受热不分解).(写出计算过程)
煅烧石灰石方法可用于测定石灰石中CaCO3含量.如图是某种石灰石煅烧过程中质量的变化曲线图.(假设杂质受热不分解).(写出计算过程)