题目内容
某同学对某地工业废水(含有硫酸和盐酸)中的H2SO4进行测定。取50g该废水于烧杯中,加入足量的BaCl2溶液,充分反应中,过滤、洗涤、干燥得到BaSO4固体11.65g。通过计算回答下列问题:
(1)50g该废水中H2SO4的质量。
(2)若改用KOH溶液来测定50g该废水中H2SO4的含量,结果会_________(填“偏高”、“偏低”、“不变”),理由是____________________。
(1)50g该废水中H2SO4的质量。
(2)若改用KOH溶液来测定50g该废水中H2SO4的含量,结果会_________(填“偏高”、“偏低”、“不变”),理由是____________________。
解:(1)设硫酸的质量为X。
H2SO4+BaCl2==BaSO4 +2HCl
+2HCl
98 233
X 11.65g
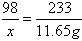 ;X=4.9g
;X=4.9g
答:硫酸的质量为4.9g
(2)偏高;说到盐酸跟氢氧化钾反应即可。
H2SO4+BaCl2==BaSO4
 +2HCl
+2HCl98 233
X 11.65g
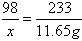 ;X=4.9g
;X=4.9g答:硫酸的质量为4.9g
(2)偏高;说到盐酸跟氢氧化钾反应即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目