题目内容
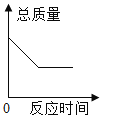
【题目】实验室制取氧气时,某同学取质量为31.6g的高锰酸钾加热,记录固体的质量与反应时间的关系如图1所示,请回答下列问题:
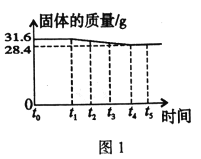
(1)t0-t1时段固体质量不变,是因为反应还未进行;t4-ts时段固体质量不变,是因为____________。
(2)t4时,制得氧气质量是____________。
(3)请计算t5时二氧化锰的质量为多少_________?
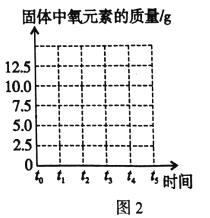
(4)请在图2坐标中,画出固体中氧元素质量在t0-t5时段的变化曲线_________。(应做适当标注)
【答案】反应已进行完全 3.2g 8.7g 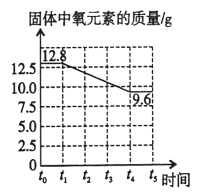
【解析】
(1)高锰酸钾分解生成氧气需要温度达到一定的温度,故t0-t1时段固体质量不变,t1-t4段内高锰酸钾分解生成氧气,当高锰酸钾完全分解后,固体的质量不再改变。
(2)由图可知,t4时,制得氧气质量是31.6g-28.4g=3.2g。
(3)温度达到t4后,生成二氧化锰的质量不再改变,设生成3.2g的氧气,同时可生成二氧化锰的质量为x
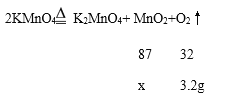
![]()
x=8.7g
(4)t0-t1时,高锰酸钾没有开始分解,故氧元素的含量不变,31.6g的高锰酸钾中氧元素的质量为:31.6g×![]() =12.8g,当温度在t1-t4,由于高锰酸钾分解生成氧气,故固体中氧元素的质量减少为12.8g-3.2g=9.6g,当温度大于t4时,高锰酸钾分解完全,故氧元素的质量不变,故变化曲线如下:
=12.8g,当温度在t1-t4,由于高锰酸钾分解生成氧气,故固体中氧元素的质量减少为12.8g-3.2g=9.6g,当温度大于t4时,高锰酸钾分解完全,故氧元素的质量不变,故变化曲线如下:

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目