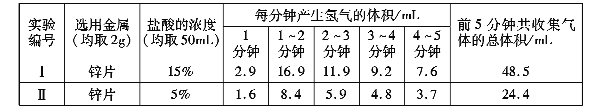
题目内容
【题目】现有工厂丢弃的废铜屑(铜屑表面呈绿色).课外活动小组同学欲利用其制取硫酸铜晶体,他们设计了下面的两种制取流程.请回答:
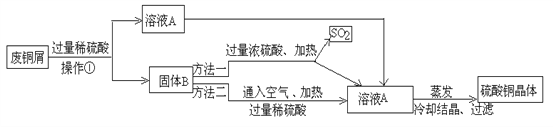
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3,从组成分析,预测它除了能与稀硫酸反应后,还能与_____________(任举一例)反应。操作①所用的玻璃仪器有烧杯、玻璃棒和 ____________;溶液A的溶质有__________________;两种方法得到硫酸铜晶体,你觉得符合绿色化学要求的方法是________ 。
(2)方法二的化学反应的化学方程式为2Cu+2H2SO4+ _____= 2CuSO4+_________。
(3)硫酸铜晶体广泛应用在电镀、印染、农药等方面,波尔多液是一种农业常用杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁制容器来配制波尔多液的原因是(用化学方程式表示)__________________________________________,此反应属于基本反应类型中的__________反应。
(4)理论上废铜屑中的铜完全可以转化为硫酸铜。已知废铜屑的质量为100kg,若最后所得的硫酸铜质量为80kg,则废铜屑中铜的质量分数为___________ 。
【答案】 HCl等 漏斗 CuSO4、H2SO4 方法二 O2 2H2O Fe+CuSO4=Cu+FeSO4 置换 32%
【解析】(1)绿色的物质化学式是Cu2(OH)2CO3,从组成分析,含有氢氧根离子、碳酸根离子,故能与酸反应。过滤操作用到的玻璃仪器有烧杯、玻璃棒、漏斗。Cu2(OH)2CO3与硫酸反应生成CuSO4,因为加入的是过量稀硫酸,故溶液A的溶质有 CuSO4、H2SO4 。方法一中产生了空气污染物二氧化硫,故方法二符合绿色化学要求。(2)因为空气中的氧气化学性质较活泼,故是氧气参与反应,根据质量守恒定律,生成物应该是水。(3)金属活动性顺序中,铁位于铜的前面,排前置后,Fe+CuSO4=Cu+FeSO4 ,用铁制容器来配制波尔多液,会腐蚀铁制容器。单化化单是置换。(4)设废铜屑中铜的质量为x,
Cu-----CuSO4
64 160
x 80kg
![]() =
=![]() 解得x=32kg
解得x=32kg
则废铜屑中铜的质量分数为: ![]() 100%= 32%
100%= 32%