题目内容
某氯化钠溶液中含有少量的氯化钡和氢氧化钠溶液杂质,它们的质量比为13:10.欲将两种杂质同时除去,得到纯净的氯化钠溶液,可选用的试剂组合是( )
【答案】分析:本题属于除杂质题,还包含了有关的计算.一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.氯化钠溶液中含有少量的氯化钡溶液杂质,可以用硫酸(或硫酸钠)除去;含有的氢氧化钠溶液杂质,可以用稀盐酸除去,还要注意滴加试剂的先后顺序.再根据有关化学方程式的计算,计算出所需要的质量比即可.
解答:解:A、设硫酸的质量为x;生成氯化氢的质量为y;氢氧化钠共需要盐酸的质量为z
BaCl2+H2SO4=BaSO4↓+2HCl NaOH+HCl=NaCl+H2O
208 98 73 40 36.5
13g x y 10g z
x=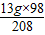 =6.125g y=
=6.125g y=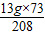 =4.5625g z=
=4.5625g z=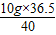 =9.125g z-y=9.125g-4.5625g=4.5625g
=9.125g z-y=9.125g-4.5625g=4.5625g
因此,盐酸和硫酸溶液的溶质的质量比为: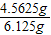 =
= 故选项A正确;
故选项A正确;
B、设氢氧化钠需要盐酸溶质的质量为x,硫酸钠的质量为y
NaOH+HCl=NaCl+H2O BaCl2+Na2SO4=BaSO4↓+2NaCl
40 36.5 208 142
10g x 13g y
x=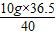 =9.125g y=
=9.125g y=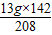 =8.875g
=8.875g
因此,盐酸和硫酸钠溶液的溶质的质量比为: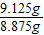 =
=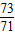 故选项B正确;
故选项B正确;
C、用硫酸和硫酸钠溶液时,也会加入新的杂质硫酸钠.故选项C不正确;
D、用硫酸和硫酸镁溶液,会加入新的杂质氯化镁,故选项D不正确;
故选A、B
点评:本考点属于物质的除杂或净化的探究,又结合了根据化学方程式的计算,属于难度比较大的题,也是学生经常出错的题型.综合性比较强,要牢记除杂质的条件,并认真分析,综合把握,从而突破本难点.
解答:解:A、设硫酸的质量为x;生成氯化氢的质量为y;氢氧化钠共需要盐酸的质量为z
BaCl2+H2SO4=BaSO4↓+2HCl NaOH+HCl=NaCl+H2O
208 98 73 40 36.5
13g x y 10g z
x=
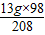 =6.125g y=
=6.125g y=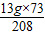 =4.5625g z=
=4.5625g z=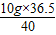 =9.125g z-y=9.125g-4.5625g=4.5625g
=9.125g z-y=9.125g-4.5625g=4.5625g因此,盐酸和硫酸溶液的溶质的质量比为:
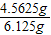 =
= 故选项A正确;
故选项A正确;B、设氢氧化钠需要盐酸溶质的质量为x,硫酸钠的质量为y
NaOH+HCl=NaCl+H2O BaCl2+Na2SO4=BaSO4↓+2NaCl
40 36.5 208 142
10g x 13g y
x=
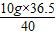 =9.125g y=
=9.125g y=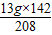 =8.875g
=8.875g 因此,盐酸和硫酸钠溶液的溶质的质量比为:
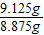 =
=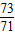 故选项B正确;
故选项B正确;C、用硫酸和硫酸钠溶液时,也会加入新的杂质硫酸钠.故选项C不正确;
D、用硫酸和硫酸镁溶液,会加入新的杂质氯化镁,故选项D不正确;
故选A、B
点评:本考点属于物质的除杂或净化的探究,又结合了根据化学方程式的计算,属于难度比较大的题,也是学生经常出错的题型.综合性比较强,要牢记除杂质的条件,并认真分析,综合把握,从而突破本难点.

练习册系列答案
相关题目
 化学与生活联系密切,生活中处处有化学.
化学与生活联系密切,生活中处处有化学.