题目内容
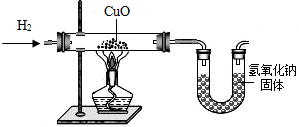
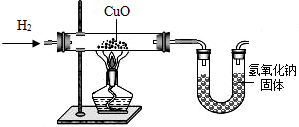
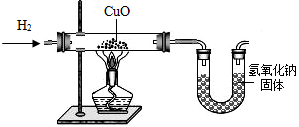
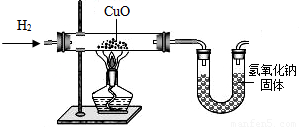
利用氢气还原氧化铜实验测定水的组成(如图所示)。请回答下列问题:
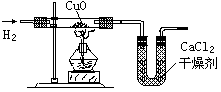
(1)实验中,用锌粒和稀硫酸反应制取氢气。
检验了氢气的纯度后,应先通一段时间氢气,
再加热氧化铜进行反应,其主要目的是________
_______________________。
(2)实验中,某次测定的数据如下表所示:
| 实验前 | 实验后 | |
| 氧化铜和玻璃的总质量 | 65.6 g | 59.2 g |
| 氯化钙和U型管的总质量 | 100.8 g | 108.0 g |
根据数据计算生成的水中,氧、氢元素的质量比(要求有计算式):______________________________
(3)下列情况中,对实验测定结果一定没有影响的是(填序号)____________。①对CuO而言,H2是过量的;②制得的H2中含有水分;③反应中部分CuO变成Cu2O;④干燥剂CaCl2有部分失效;⑤用NaOH代替CaCl2作干燥剂。⑥CuO粉末中含有不与H2反应的杂质;
(1)把空气排净,防止通入的氢气与空气混合,引起爆炸
(2)8:1 (3)①③⑥

练习册系列答案
相关题目
 利用氢气还原氧化铜实验测定水的组成如图1,请回答下列问题:
利用氢气还原氧化铜实验测定水的组成如图1,请回答下列问题: