题目内容
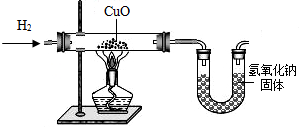
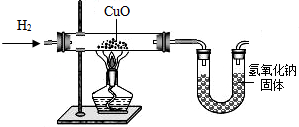
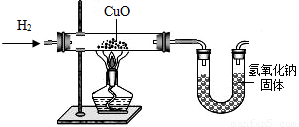
利用氢气还原氧化铜实验测定水的组成(如图所示).请回答下列问题:

(1)实验中,用锌粒和稀硫酸反应制取氢气.实验开始前需要先检验______,然后应先通一段时间氢气,再加热氧化铜进行反应,其主要目的是______,写出该反应的化学方程式______.
(2)用现有的装置测得,水中氢、氧元素的质量比大于1:8,出现该结果的可能的原因有哪些?______.
解:(1)氢气是可燃性气体,所以在完成氢气的性质实验时必须先验纯,为了使玻璃管中的空气被完全排出,防止发生危险,应该先通一段时间氢气,再加热氧化铜进行反应,氢气和氧化铜反应生成了铜和水,其反应的化学方程式为:H2+CuO H2O+Cu;
H2O+Cu;
(2)本实验中通过测量玻璃管的质量减少来测量氧元素的质量,所以如果玻璃管中有H2O冷却的话,那么就会使玻璃管的前后质量差减小,也就是测得的O的质量较实际要小,所以相应的H就要变多,从而会导致测的结果大于1:8;同时由于干燥管和空气相连,缺少干燥装置,那么可能会有部分的水分并未被干燥管完全吸收,导致测得的H2O的质量比实际要少,所以,计算得到的O比原来小,也会导致测定的结果大于1:8.
故答案为:
(1)氢气的纯度;排尽玻璃管中的空气,防止发生爆炸;H2+CuO H2O+Cu;
H2O+Cu;
(2)水蒸气在玻璃管中冷却或干燥管和空气相连,缺少干燥装置,那么可能会有部分的水分并未被干燥管完全吸收,导致测得的H2O的质量比实际要少等合理的答案.
分析:(1)根据氢气的性质来完成该题的解答,并写出氢气还原氧化铜的化学方程式;
(2)根据实验过程中的注意事项、装置的特点及反应的环境来完成解答.
点评:本题为典型的实验探究题,熟练掌握氢气还原氧化铜的性质和实验才能准确解答该题,要分析清楚每步实验的目的即可准确解答该题.
 H2O+Cu;
H2O+Cu;(2)本实验中通过测量玻璃管的质量减少来测量氧元素的质量,所以如果玻璃管中有H2O冷却的话,那么就会使玻璃管的前后质量差减小,也就是测得的O的质量较实际要小,所以相应的H就要变多,从而会导致测的结果大于1:8;同时由于干燥管和空气相连,缺少干燥装置,那么可能会有部分的水分并未被干燥管完全吸收,导致测得的H2O的质量比实际要少,所以,计算得到的O比原来小,也会导致测定的结果大于1:8.
故答案为:
(1)氢气的纯度;排尽玻璃管中的空气,防止发生爆炸;H2+CuO
 H2O+Cu;
H2O+Cu;(2)水蒸气在玻璃管中冷却或干燥管和空气相连,缺少干燥装置,那么可能会有部分的水分并未被干燥管完全吸收,导致测得的H2O的质量比实际要少等合理的答案.
分析:(1)根据氢气的性质来完成该题的解答,并写出氢气还原氧化铜的化学方程式;
(2)根据实验过程中的注意事项、装置的特点及反应的环境来完成解答.
点评:本题为典型的实验探究题,熟练掌握氢气还原氧化铜的性质和实验才能准确解答该题,要分析清楚每步实验的目的即可准确解答该题.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
 利用氢气还原氧化铜实验测定水的组成如图1,请回答下列问题:
利用氢气还原氧化铜实验测定水的组成如图1,请回答下列问题: