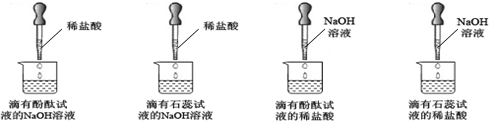
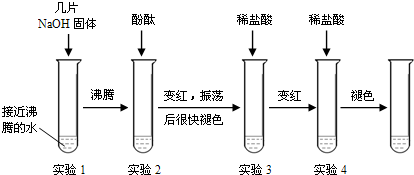
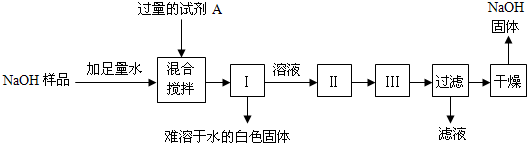
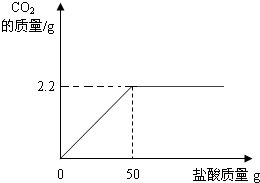
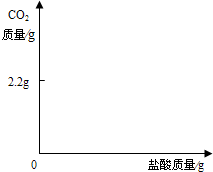
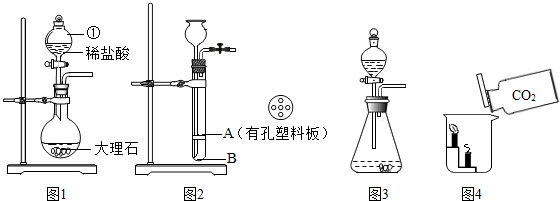
题目内容
(1)在下图的烧杯中盛有65℃的热水,杯底放有一小颗足量的白磷,然后将一支有刻度的空大试管插入烧杯中,试管口罩住白磷(已知白磷熔点为44℃,着火点为40℃).回答下列问题:
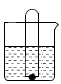
试验过程中发生的现象是:________________.
该试验说明了:①________________________;②________________________.
(2)若在太空飞船上的一个充满氧气的密封容器内,将红磷加热到着火点使之与氧气反应,所观察到的现象是________________.产生的原因是________________.
答案:
解析:
解析:
|
未插入空试管前,白磷熔化,插入空试管后燃烧,水进入试管占试管容积的1/5 ①燃烧不但需要温度达到着火点,还必须跟助燃气体接触 ②空气中氧气占总体积的1/5 (2)燃烧不剧烈,断断续续生成五氧化二磷在空间漂浮 太空无重力,燃烧只能靠反应物扩散相遇而进行,生成五氧化二磷只能靠扩散漂在空间 |

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目