题目内容
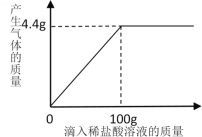
【题目】在实验室里,二氧化碳气体常用稀盐酸与大理石或石灰石反应来制取。现称取12.5克大理石样品放入锥形瓶中,再向锥形瓶中加入100克稀盐酸,稀盐酸与大理石恰好完全反应(杂质不与稀盐酸反应),稀盐酸的用量与产生二氧化碳的质量关系如下图所示,请你计算:
(1)恰好完全反应后锥形瓶中剩余物质的总质量是 克;
(2)大理石样品中碳酸钙的质量分数。
【答案】(1)108.1(2)80%
【解析】
(1)根据质量守恒定律可知,恰好完全反应后锥形瓶中剩余物质的总质量是:100克+12.5克-4.4克=108.1克,故填写:108.1;
(2)解:设大理石样品中碳酸钙的质量为x。
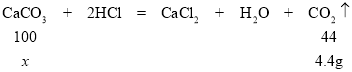
100:44=x: 4.4g
解得: x=10g
大理石样品中碳酸钙的质量分数![]() ×100% =80%
×100% =80%
答: 锥形瓶中剩余物质的总质量为108.1克
大理石样品中碳酸钙的质量分数为80%

练习册系列答案
相关题目