题目内容
17.(2010?宜宾)实验室制取二氧化碳后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取100g该溶液于烧杯中,滴入40g溶质质量分数为21.2%的碳酸钠溶液,充分反应后过滤.滴入碳酸钠溶液质量与生成物沉淀质量的关系如右图所示.求(1)所取100g混合溶液中氯化氢的质量分数.
(2)实验结束后,将过滤所得的溶液蒸干,得到固体的质量.
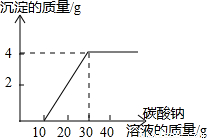
【答案】分析:(1)由图示可知,开始滴入10g碳酸钠溶液时没有沉淀生成,说明是与盐酸发生反应.故与盐酸发生反应的碳酸钠的质量为10g×21.2%=2.12g,然后根据化学方程式,得出各物质之间的质量比,列出比例式,就可计算出混合溶液中氯化氢的质量和生成氯化钠的质量的质量.然后根据溶质质量分数公式就可计算出混合溶液中氯化氢的质量分数;
(2)由题意可知,将过滤所得的溶液蒸干,得到固体的质量即生成的NaCl的质量与未反应完的碳酸钠的质量.根据图示可知,与氯化钙反应的碳酸钠溶液的质量为20g,根据溶液的溶质质量分数计算出碳酸钠的质量.然后根据化学方程式,得出各物质之间的质量比,列出比例式,就可计算出生成氯化钠的质量.根据溶液的溶质质量分数就可计算出未反应完的碳酸钠的质量.
解答:解:(1)根据图示可知,与盐酸反应的碳酸钠的质量为:10g×21.2%=2.12g.
设100g混合溶液中氯化氢的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117
2.12g x y
∴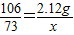 ,
,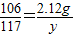
解之得:X=1.46g,y=2.34g,
混合溶液中氯化氢的质量分数为: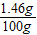 ×100%=1.46%.
×100%=1.46%.
(2)根据图示与氯化钙反应的碳酸钠的质量为:20g×21.2%=4.24g,
设生成氯化钠的质量为z.
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 117
4.24g z
∴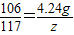
解之得:z=4.68g,
根据图示未反应的碳酸钠的质量为:10g×21.2%=2.12g.
实验结束后,将过滤所得的溶液蒸干,得到固体的质量为:2.34g+4.68g+2.12g=9.14g.
答:实验结束后,将过滤所得的溶液蒸干,得到固体的质量为9.14g.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.
(2)由题意可知,将过滤所得的溶液蒸干,得到固体的质量即生成的NaCl的质量与未反应完的碳酸钠的质量.根据图示可知,与氯化钙反应的碳酸钠溶液的质量为20g,根据溶液的溶质质量分数计算出碳酸钠的质量.然后根据化学方程式,得出各物质之间的质量比,列出比例式,就可计算出生成氯化钠的质量.根据溶液的溶质质量分数就可计算出未反应完的碳酸钠的质量.
解答:解:(1)根据图示可知,与盐酸反应的碳酸钠的质量为:10g×21.2%=2.12g.
设100g混合溶液中氯化氢的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117
2.12g x y
∴
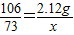 ,
,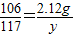
解之得:X=1.46g,y=2.34g,
混合溶液中氯化氢的质量分数为:
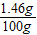 ×100%=1.46%.
×100%=1.46%.(2)根据图示与氯化钙反应的碳酸钠的质量为:20g×21.2%=4.24g,
设生成氯化钠的质量为z.
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 117
4.24g z
∴
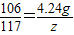
解之得:z=4.68g,
根据图示未反应的碳酸钠的质量为:10g×21.2%=2.12g.
实验结束后,将过滤所得的溶液蒸干,得到固体的质量为:2.34g+4.68g+2.12g=9.14g.
答:实验结束后,将过滤所得的溶液蒸干,得到固体的质量为9.14g.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目