题目内容
 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题:
(1)石灰厂要得到20t氧化钙,至少需要含碳酸钙90%的石灰石______t
(2)取98%的浓硫酸10m1(密度1.84g/cm3)配制成10%的硫酸溶液,需水______g
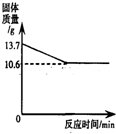
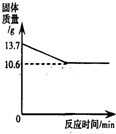
(3)碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如图所示.另取相同质量的该混合物溶于水得到56.6g溶液,向该溶液中加入50g 7.3%的稀盐酸,恰好完全反应(反应后溶液中只有一种溶质).(已知:2NaHCO3 Na2CO3+CO2↑+H2O,碳酸钠受热不易分解.)
Na2CO3+CO2↑+H2O,碳酸钠受热不易分解.)
(a)固体混合物充分加热至恒重质量减少的是______的质量.(填物质的名称)
(b)固体混合物与足量的稀盐酸反应生成二氧化碳的质量为______g
(c)最终所得溶液中溶质的质量分数为______.
解:(1)设石灰石的质量为x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
x×90% 20t
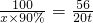
x=39.7g
(2)设需加水的质量为y
98%×10ml×1.84g/ml=10%×(10ml×1.84g/ml+x)
x=161.92g
(3)(a)固体混合物充分加热至恒重,根据质量守恒定律和碳酸氢钠分解的化学方程式,固体减少的质量为生成的水和二氧化碳的质量之和;
(b)设碳酸氢钠的质量为x,生成碳酸钠质量为y
2NaHCO3 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
44 18
可得碳酸氢钠分解生成二氧化碳的质量为:(13.7g-10.6g)×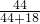 =2.2g
=2.2g
根据图示可知碳酸氢钠完全分解所得固体碳酸钠的质量为10.6g
设碳酸钠与盐酸反应生成二氧化碳的质量为x、所得溶液中溶质氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
10.6g y x
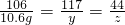
x=4.4g
y=11.7g
(b)混合物与盐酸反应生成二氧化碳的质量为:2.2g+4.4g=6.6g.
(c)所得溶液中溶质的质量分数为: ×100%=11.7%
×100%=11.7%
答:(b)混合物与盐酸反应生成二氧化碳的质量为6.6g.
(c)所得溶液中溶质的质量分数为11.77%.
故答案为:(1)39.7(2)161.92g(3)(a)二氧化碳和水 (b)6.6g(c)11.7%
分析:(1)根据碳酸钙分解的化学方程式已知氧化钙质量求出石灰石质量.
(2)根据溶液加水稀释前后溶质质量不变分析
(3)(a)碳酸氢钠分解生成碳酸钠、水和二氧化碳,固体减少的质量即为二氧化碳和水的质量.
(b)因“碳酸钠和碳酸氢钠的固体混合物充分加热至恒重”,所得固体为碳酸钠,根据碳酸氢钠分解的化学方程式和质量守恒定律因反应前后固体物质中碳元素、钠元素的量没有改变,仍在固体中,故根据反应后碳酸钠的质量计算生成的二氧化碳、氯化钠的质量与碳酸钠和碳酸氢钠的固体混合物和盐酸反应生成的二氧化碳、氯化钠的质量是相等的;
(c)根据溶质质量分数计算公式分析
点评:本题考查根据化学方程式的计算及溶液稀释的计算,要充分挖掘题目中的条件,考虑到影响物质质量变化的各种因素,如放出气体、生成沉淀、生成水等.
CaCO3
 CaO+CO2↑
CaO+CO2↑100 56
x×90% 20t
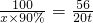
x=39.7g
(2)设需加水的质量为y
98%×10ml×1.84g/ml=10%×(10ml×1.84g/ml+x)
x=161.92g
(3)(a)固体混合物充分加热至恒重,根据质量守恒定律和碳酸氢钠分解的化学方程式,固体减少的质量为生成的水和二氧化碳的质量之和;
(b)设碳酸氢钠的质量为x,生成碳酸钠质量为y
2NaHCO3
 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O44 18
可得碳酸氢钠分解生成二氧化碳的质量为:(13.7g-10.6g)×
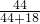 =2.2g
=2.2g根据图示可知碳酸氢钠完全分解所得固体碳酸钠的质量为10.6g
设碳酸钠与盐酸反应生成二氧化碳的质量为x、所得溶液中溶质氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
10.6g y x
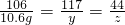
x=4.4g
y=11.7g
(b)混合物与盐酸反应生成二氧化碳的质量为:2.2g+4.4g=6.6g.
(c)所得溶液中溶质的质量分数为:
 ×100%=11.7%
×100%=11.7%答:(b)混合物与盐酸反应生成二氧化碳的质量为6.6g.
(c)所得溶液中溶质的质量分数为11.77%.
故答案为:(1)39.7(2)161.92g(3)(a)二氧化碳和水 (b)6.6g(c)11.7%
分析:(1)根据碳酸钙分解的化学方程式已知氧化钙质量求出石灰石质量.
(2)根据溶液加水稀释前后溶质质量不变分析
(3)(a)碳酸氢钠分解生成碳酸钠、水和二氧化碳,固体减少的质量即为二氧化碳和水的质量.
(b)因“碳酸钠和碳酸氢钠的固体混合物充分加热至恒重”,所得固体为碳酸钠,根据碳酸氢钠分解的化学方程式和质量守恒定律因反应前后固体物质中碳元素、钠元素的量没有改变,仍在固体中,故根据反应后碳酸钠的质量计算生成的二氧化碳、氯化钠的质量与碳酸钠和碳酸氢钠的固体混合物和盐酸反应生成的二氧化碳、氯化钠的质量是相等的;
(c)根据溶质质量分数计算公式分析
点评:本题考查根据化学方程式的计算及溶液稀释的计算,要充分挖掘题目中的条件,考虑到影响物质质量变化的各种因素,如放出气体、生成沉淀、生成水等.

练习册系列答案
相关题目
 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题:
(1)将放浓硫酸的试剂瓶露置在空气中一段时间后溶液的质量分数会________(填变大或变小)
(2)某厂以流量10L.s-1排出含硫酸9.8%的工业废水,现往该废水中排入含氢氧化钠2%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,则氢氧化钠的流量应当为________(假设含酸废水的密度和含碱废水的密度约为1g.cm-3)
(3)四种氮肥:(NH4)2SO4、NH4HCO3、NH4NO3、CO(NH2)2(尿素),含氮量最低是________(填名称)
(4)为检验糖尿病患者的尿液,医院要配置8%的CuSO4溶液.现有16g硫酸铜同体,可配置该硫酸铜溶液________g,需水________ml(水的密度为1.0g.cm-3).
(5)火力发电厂用石灰浆吸收废气中的二氧化硫,以防止污染环境,其发生发应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2.若100克废气中含有1.6克二氧化硫,则处理1000克这种废气需要含碳酸钙80%的石灰石________克.
(6)某校化学兴趣小组为测定某硝酸铵样品的纯度,将样品溶于水后,再加入氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOH NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:
NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(b)表中m约为________.
请根据下面有关信息,按题目要求回答问题:
(1)将放浓硫酸的试剂瓶露置在空气中一段时间后溶液的质量分数会 (填变大或变小)
(2)某厂以流量10L.s-1排出含硫酸9.8%的工业废水,现往该废水中排入含氢氧化钠2%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,则氢氧化钠的流量应当为 (假设含酸废水的密度和含碱废水的密度约为1g.cm-3)
(3)四种氮肥:(NH4)2SO4、NH4HCO3、NH4NO3、CO(NH2)2(尿素),含氮量最低是 (填名称)
(4)为检验糖尿病患者的尿液,医院要配置8%的CuSO4溶液.现有16g硫酸铜同体,可配置该硫酸铜溶液 g,需水 ml(水的密度为1.0g.cm-3).
(5)火力发电厂用石灰浆吸收废气中的二氧化硫,以防止污染环境,其发生发应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2.若100克废气中含有1.6克二氧化硫,则处理1000克这种废气需要含碳酸钙80%的石灰石 克.
(6)某校化学兴趣小组为测定某硝酸铵样品的纯度,将样品溶于水后,再加入氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOH NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:
NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:
(a)请在下面的坐标纸上,以反应时间为横坐标,以产生的NH3质量为纵坐标,画山能够表明产生气体的质量随时间变化的关系曲线:
(b)表中m约为 .
(1)将放浓硫酸的试剂瓶露置在空气中一段时间后溶液的质量分数会 (填变大或变小)
(2)某厂以流量10L.s-1排出含硫酸9.8%的工业废水,现往该废水中排入含氢氧化钠2%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,则氢氧化钠的流量应当为 (假设含酸废水的密度和含碱废水的密度约为1g.cm-3)
(3)四种氮肥:(NH4)2SO4、NH4HCO3、NH4NO3、CO(NH2)2(尿素),含氮量最低是 (填名称)
(4)为检验糖尿病患者的尿液,医院要配置8%的CuSO4溶液.现有16g硫酸铜同体,可配置该硫酸铜溶液 g,需水 ml(水的密度为1.0g.cm-3).
(5)火力发电厂用石灰浆吸收废气中的二氧化硫,以防止污染环境,其发生发应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2.若100克废气中含有1.6克二氧化硫,则处理1000克这种废气需要含碳酸钙80%的石灰石 克.
(6)某校化学兴趣小组为测定某硝酸铵样品的纯度,将样品溶于水后,再加入氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOH
 NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:
NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质最,结果如下表所示:| 时间/s | 20 | 30 | 40 | 60 | 80 | 100 | 120 | |
| 增加的质量/g | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(b)表中m约为 .

 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题: