题目内容
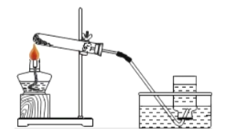
【题目】某种钙片标签上标注每片2.5克,每片含CaCO3的质量不小于1.24克。某同学为测定钙片中碳酸钙的含量标注是否属实,他取出4片片剂,研碎后放入锥形瓶中,用图所示装置,将100克稀盐酸(足量)全部加入锥形瓶中,至不再放出气体为止,天平示数的变化如图所示,(假定钙片中其它成分不与盐酸反应)求:

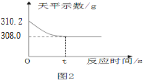
(1)生成二氧化碳的质量________________
(2)通过计算判断钙片中碳酸钙的含量标注是否属实_____________。
【答案】2.2g 钙片中碳酸钙的含量标注属实
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算钙片中所含碳酸钙的质量。
解:(1)根据质量守恒定律可得,生成CO2的质量:310.2g-308.0g=2.2g;
(2)4片钙片质量为2.5g×4=10g,设10克钙片中碳酸钙的质量为x,
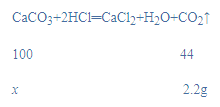
![]()
x=5g,
每片钙片中碳酸钙的质量为5g÷4=1.25g>1.24g,所以标注属实;
答:(1)生成CO2的质量为2.2g;(2)钙片中碳酸钙的含量标注属实。

练习册系列答案
相关题目