题目内容
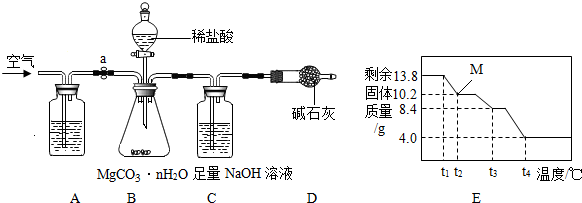
碳酸镁晶须广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行了3次实验:(不考虑稀盐酸挥发)
[查阅资料]:
a、碳酸镁晶体受热分解,生成3种氧化物;
b、相对分子质量:[Mr(MgCO3):84、Mr(H2O):18、Mr(MgO):40、Mr(CO2):44]
[实验步骤]
① ;
②准确称取3.45g MgCO3?nH2O放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,称量C装置的质量;
④关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止;
⑤打开弹簧夹a, ;
⑥准确称量C装置的质量(如表);
| 编 号 | 1 | 2 | 3 |
| 实验前 | 228.00 | 228.00 | 228.00 |
| 实验后 | 229.10 | 229.11 | 229.09 |
⑧根据数据进行计算.
[实验分析及数据处理]
(1)完善实验步骤:① ;⑤ ;
(2)请计算碳酸镁晶须中的n值.(要求有计算过程,3分)
(3)A装置中盛放的溶液是 ;
(4)D装置的作用是 ;
[实验反思]
(5)实验结果与理论值有偏差,原因可能是 ;
(6)下列选项中,会造成实验结果偏大的是 ;偏小的是 ;
①反应结束后,没有通空气; ②称量C装置前,没有通空气;
③没有A装置; ④没有D装置;
⑤稀盐酸滴加速率太快; ⑥C装置中NaOH溶液浓度过大;
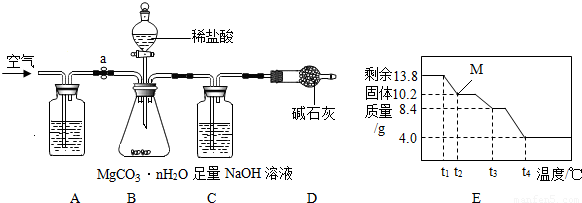
(7)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3?nH2O进行热重分析,并绘制出如图所示的热重曲线示意图.则:

①t2℃时,剩余固体为 (填化学式);
②最终剩余的4.0g物质是 (填化学式);
③MgCO3?nH2O完全分解的化学方程式为: .
【答案】分析:(1)根据实验目的分析实验步骤
(2)根据二氧化碳与碳酸镁晶体的质量关系分析
(3)根据实验目的分析氢氧化钠溶液的作用
(4)根据C装置的作用分析D装置的作用
(5)根据实验步骤分析出现实验误差的原因
(6)根据操作步骤引起的二氧化碳质量 的变化分析对n值的影响
(7)根据图象分析晶体分解过程及产物
解答:解:(1)有气体生成的装置必须先检查装置的气密性.通过碳酸镁晶体与盐酸反应产生二氧化碳的质量确定n的值,实验前应将装置中的二氧化碳排净,因此先将除去二氧化碳的空气鼓入装置,要除去空气中二氧化碳,可将空气通过氢氧化钠溶液吸收,然后关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止,打开弹簧夹a,缓缓鼓入空气,使产生的二氧化碳全部排到C装置中,C装置增重的质量即为生成的二氧化碳的质量.
(2)3次实验C装置平均增重(1.1+1.11+1.09)g/3=1.1g
MgCO3?nH2O~CO2
84+18n 44
3.45g 1.1g
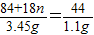
解得:n=3
(3)由上述分析可知A装置内盛的是氢氧化钠溶液,以吸收空气中的二氧化碳,防止对生成二氧化碳质量的干扰,.
(4)D装置碱石灰的作用是防止空气中的CO2进入C装置,造成误差
(5)实验结果与理论值有偏差,原因可能是B装置生成的CO2带出的水蒸气一同进入C装置
(6)①反应结束后,没有通空气,产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大
②称量C装置前,没有通空气,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
③没有A装置,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
④没有D装置,使外界空气中二氧化碳进入C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
⑤稀盐酸滴加速率太快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大
⑥C装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响.
(7)①由第(2)问计算可知该晶体的化学式为MgCO3?3H2O,由图象可知该晶体分解过程先分解生成水,当结晶水全部失去后碳酸镁分解生成氧化镁和水,设t2℃时,剩余固体化学式为MgCO3?xH2O,则此时分解的化学方程式为
MgCO3?3H2O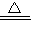 MgCO3?xH2O+(3-x)H2O
MgCO3?xH2O+(3-x)H2O
138 84+x×18
13.8g 10.2g
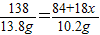
x=1
故此时物质的化学式为MgCO3?H2O
②根据分解过程可知最终分解过程是碳酸镁完全分解生成氧化镁和水,因此最终固体是氧化镁,化学式为MgO
③MgCO3?nH2O完全分解的化学方程式为MgCO3?3H2O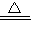 MgO+CO2↑+3H2O
MgO+CO2↑+3H2O
故答案为:(1)①检查气密性 ⑤缓缓鼓入空气
(2)3次实验C装置平均增重(1.1+1.11+1.09)g/3=1.1g
MgCO3?nH2O~CO2
84+18n 44
3.45g 1.1g
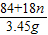 =
=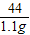
解得:n=3
(3)NaOH(浓)溶液
(4)防止空气中的CO2进入C装置,造成误差
(5)B装置生成的CO2带出的水蒸气一同进入C装置
(6)①⑤②③④
(7)①MgCO3?H2O ②MgO ③MgCO3?3H2O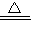 MgO+CO2↑+3H2O
MgO+CO2↑+3H2O
点评:本题考查通过分析实验数据测定物质组成,要注意保证产生的二氧化碳全部被吸收,同时要排除装置内空气中的二氧化碳进入C装置.
(2)根据二氧化碳与碳酸镁晶体的质量关系分析
(3)根据实验目的分析氢氧化钠溶液的作用
(4)根据C装置的作用分析D装置的作用
(5)根据实验步骤分析出现实验误差的原因
(6)根据操作步骤引起的二氧化碳质量 的变化分析对n值的影响
(7)根据图象分析晶体分解过程及产物
解答:解:(1)有气体生成的装置必须先检查装置的气密性.通过碳酸镁晶体与盐酸反应产生二氧化碳的质量确定n的值,实验前应将装置中的二氧化碳排净,因此先将除去二氧化碳的空气鼓入装置,要除去空气中二氧化碳,可将空气通过氢氧化钠溶液吸收,然后关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止,打开弹簧夹a,缓缓鼓入空气,使产生的二氧化碳全部排到C装置中,C装置增重的质量即为生成的二氧化碳的质量.
(2)3次实验C装置平均增重(1.1+1.11+1.09)g/3=1.1g
MgCO3?nH2O~CO2
84+18n 44
3.45g 1.1g
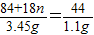
解得:n=3
(3)由上述分析可知A装置内盛的是氢氧化钠溶液,以吸收空气中的二氧化碳,防止对生成二氧化碳质量的干扰,.
(4)D装置碱石灰的作用是防止空气中的CO2进入C装置,造成误差
(5)实验结果与理论值有偏差,原因可能是B装置生成的CO2带出的水蒸气一同进入C装置
(6)①反应结束后,没有通空气,产生的二氧化碳没有全部排到C装置,使二氧化碳的质量偏小,引起结果偏大
②称量C装置前,没有通空气,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
③没有A装置,使空气中二氧化碳被C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
④没有D装置,使外界空气中二氧化碳进入C装置吸收,使二氧化碳的质量偏大,引起结果偏小.
⑤稀盐酸滴加速率太快,产生的二氧化碳没有全部被C装置吸收,使二氧化碳的质量偏小,引起结果偏大
⑥C装置中NaOH溶液浓度过大,不会影响二氧化碳的质量,对结果没有影响.
(7)①由第(2)问计算可知该晶体的化学式为MgCO3?3H2O,由图象可知该晶体分解过程先分解生成水,当结晶水全部失去后碳酸镁分解生成氧化镁和水,设t2℃时,剩余固体化学式为MgCO3?xH2O,则此时分解的化学方程式为
MgCO3?3H2O
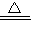 MgCO3?xH2O+(3-x)H2O
MgCO3?xH2O+(3-x)H2O138 84+x×18
13.8g 10.2g
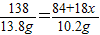
x=1
故此时物质的化学式为MgCO3?H2O
②根据分解过程可知最终分解过程是碳酸镁完全分解生成氧化镁和水,因此最终固体是氧化镁,化学式为MgO
③MgCO3?nH2O完全分解的化学方程式为MgCO3?3H2O
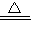 MgO+CO2↑+3H2O
MgO+CO2↑+3H2O故答案为:(1)①检查气密性 ⑤缓缓鼓入空气
(2)3次实验C装置平均增重(1.1+1.11+1.09)g/3=1.1g
MgCO3?nH2O~CO2
84+18n 44
3.45g 1.1g
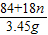 =
=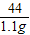
解得:n=3
(3)NaOH(浓)溶液
(4)防止空气中的CO2进入C装置,造成误差
(5)B装置生成的CO2带出的水蒸气一同进入C装置
(6)①⑤②③④
(7)①MgCO3?H2O ②MgO ③MgCO3?3H2O
 MgO+CO2↑+3H2O
MgO+CO2↑+3H2O点评:本题考查通过分析实验数据测定物质组成,要注意保证产生的二氧化碳全部被吸收,同时要排除装置内空气中的二氧化碳进入C装置.

练习册系列答案
相关题目
碳酸镁晶须(MgCO3?nH2O,n=1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行了3次实验:(不考虑稀盐酸挥发)

【查阅资料】:
a、碳酸镁晶须受热分解,生成3种氧化物;
b、相对分子质量:[Mr(MgCO3):84、Mr(H2O):18、Mr(MgO):40、Mr(CO2):44]
【实验步骤】
①______;
②准确称取3.45g MgCO3?nH2O放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,称量C装置的质量;
④关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止;
⑤打开弹簧夹a,______;
| 编 号 | 1 | 2 | 3 |
| 实验前 | 228.00 | 228.00 | 228.00 |
| 实验后 | 229.10 | 229.11 | 229.09 |
⑦重复上述步骤;
⑧根据数据进行计算.
【实验分析及数据处理】
(1)A装置中盛放的溶液是______,其目的是______
(2)D装置的作用是______;
(3)计算碳酸镁晶须中的n值:(要有计算过程)
【实验反思】
(4)实验结果与理论值有偏差,可以在B、C增加一个______装置以减少误差;
(5)下列选项中,会造成实验结果偏大的是______;偏小的是______;
①反应结束后,没有通空气; ②称量C装置前,没有通空气;
③没有A装置; ④没有D装置;
⑤稀盐酸滴加速率太快; ⑥C装置中NaOH溶液浓度过大;
(6)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3?nH2O进行热重分析,并绘制出图E所示的热重曲线示意图.则:
①t2℃时,剩余固体为______(填化学式);
②最终剩余的4.0g物质是______(填化学式);
③MgCO3?nH2O完全分解的化学方程式为:______.
碳酸镁晶须广泛应用于冶金、耐火材料及化工产品等领域.为测定碳酸镁晶须中n的值,学习小组设计了如下装置并进行了3次实验:(不考虑稀盐酸挥发)
【查阅资料】:
a、碳酸镁晶须受热分解,生成3种氧化物;
b、相对分子质量:[Mr(MgCO3):84、Mr(H2O):18、Mr(MgO):40、Mr(CO2):44]
【实验步骤】
①______;
②准确称取3.45g MgCO3?nH2O放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,称量C装置的质量;
④关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止;
⑤打开弹簧夹a,______;
⑥准确称量C装置的质量(如上表);
⑦重复上述步骤;
⑧根据数据进行计算.
【实验分析及数据处理】
(1)A装置中盛放的溶液是______,其目的是______
(2)D装置的作用是______;
(3)计算碳酸镁晶须中的n值:(要有计算过程)
【实验反思】
(4)实验结果与理论值有偏差,可以在B、C增加一个______装置以减少误差;
(5)下列选项中,会造成实验结果偏大的是______;偏小的是______;
①反应结束后,没有通空气; ②称量C装置前,没有通空气;
③没有A装置; ④没有D装置;
⑤稀盐酸滴加速率太快; ⑥C装置中NaOH溶液浓度过大;
(6)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3?nH2O进行热重分析,并绘制出图E所示的热重曲线示意图.则:
①t2℃时,剩余固体为______(填化学式);
②最终剩余的4.0g物质是______(填化学式);
③MgCO3?nH2O完全分解的化学方程式为:______ MgO+H2O+CO2↑

【查阅资料】:
a、碳酸镁晶须受热分解,生成3种氧化物;
b、相对分子质量:[Mr(MgCO3):84、Mr(H2O):18、Mr(MgO):40、Mr(CO2):44]
【实验步骤】
①______;
②准确称取3.45g MgCO3?nH2O放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,称量C装置的质量;
④关闭弹簧夹a,打开分液漏斗活塞,缓缓滴入稀盐酸至不再产生气体为止;
⑤打开弹簧夹a,______;
| 编 号 | 1 | 2 | 3 |
| 实验前 | 228.00 | 228.00 | 228.00 |
| 实验后 | 229.10 | 229.11 | 229.09 |
⑦重复上述步骤;
⑧根据数据进行计算.
【实验分析及数据处理】
(1)A装置中盛放的溶液是______,其目的是______
(2)D装置的作用是______;
(3)计算碳酸镁晶须中的n值:(要有计算过程)
【实验反思】
(4)实验结果与理论值有偏差,可以在B、C增加一个______装置以减少误差;
(5)下列选项中,会造成实验结果偏大的是______;偏小的是______;
①反应结束后,没有通空气; ②称量C装置前,没有通空气;
③没有A装置; ④没有D装置;
⑤稀盐酸滴加速率太快; ⑥C装置中NaOH溶液浓度过大;
(6)为精确测定n的值,在老师指导下,小组同学称取13.8g MgCO3?nH2O进行热重分析,并绘制出图E所示的热重曲线示意图.则:
①t2℃时,剩余固体为______(填化学式);
②最终剩余的4.0g物质是______(填化学式);
③MgCO3?nH2O完全分解的化学方程式为:______ MgO+H2O+CO2↑