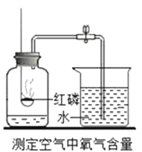
题目内容
【题目】生铁是铁和碳的合金![]() 为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品
为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品![]() ,放入烧杯中,向其中加入
,放入烧杯中,向其中加入![]() 稀硫酸,恰好完全反应
稀硫酸,恰好完全反应![]() 假设杂质不参与反应
假设杂质不参与反应![]() 测得的实验数据如表:
测得的实验数据如表:
反应前 | 反应后 | |
烧杯及其中物质的质量 |
|
|
请你完成有关计算![]() 结果保留一位小数
结果保留一位小数![]() :
:
(1)反应放出的氢气是多少____?
(2)生铁样品中铁的质量分数是多少__.
【答案】反应放出的氢气是![]() . 生铁样品中铁的质量分数是
. 生铁样品中铁的质量分数是![]() .
.
【解析】
根据质量守恒定律可得,生成氢气的质量为![]()
设参加反应的铁的质量为x
![]()
![]()
![]()
则生铁样品中铁的质量分数为![]()
根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气和对应的化学方程式求算铁的质量,进而求算对应的质量分数.
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
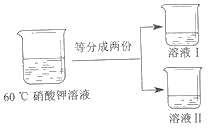
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。