题目内容
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO等,工艺流程简化示意图如下:
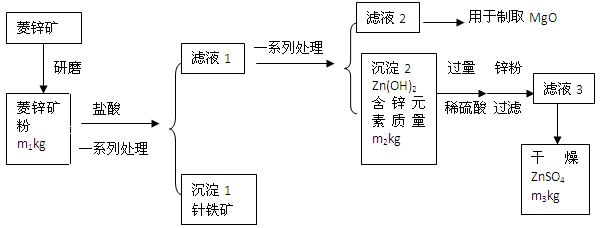
根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是_____。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=______。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式____________________________。该反应的基本类型是______
(4)“滤液3”之前加入锌粉的目的是______________
(5)“滤液3”之后的操作依次为______、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________×100%。

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是_____。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=______。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式____________________________。该反应的基本类型是______
(4)“滤液3”之前加入锌粉的目的是______________
(5)“滤液3”之后的操作依次为______、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________×100%。
(1)菱锌矿粉与盐酸充分反应;
(2)1:2:1;
(3)Zn(OH)2+H2SO4= ZnSO4+2H2O;复分解;
(4)除去剩余的硫酸;
(5)蒸发或蒸发结晶;
(6)25m2/13m1或125m2/65m1
(2)1:2:1;
(3)Zn(OH)2+H2SO4= ZnSO4+2H2O;复分解;
(4)除去剩余的硫酸;
(5)蒸发或蒸发结晶;
(6)25m2/13m1或125m2/65m1
试题分析:(1)将菱锌矿研磨成粉,可以和盐酸充分接触,从而使菱锌矿粉与盐酸充分反应。
(2)针铁矿的组成元素是Fe、O和H,相对分子质量是89,则每个分子中铁的原子个数为1(如铁原子的个数大于等2,则其相对分子质量要大于89)。设每个分子中氧原子的个数为x,氢原子的个数为y,则16x+y+56=89,可解得x:y=2:1。所以针铁矿中铁原子数︰氧原子数︰氢原子数=1:2:1。
(3)氢氧化锌和稀硫酸可发生复分解反应生成硫酸锌和水,反应的化学方程式为Zn(OH)2+H2SO4= ZnSO4+2H2O。
(4)在沉淀2中加入了过量的稀硫酸,所以“滤液3”之前加入锌粉的目的是与硫酸反应生成硫酸锌以除去剩余的硫酸。
(5)“滤液3”为硫酸锌溶液,可通过蒸发、干燥得到硫酸锌固体。
(6)根据图示可知,菱锌矿粉中ZnCO3中的锌元素会转化为Zn(OH)2,根据Zn(OH)2中锌元素的质量可计算出碳酸锌的质量分数最低为


练习册系列答案
相关题目
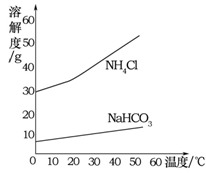
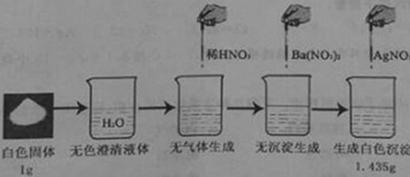

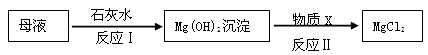
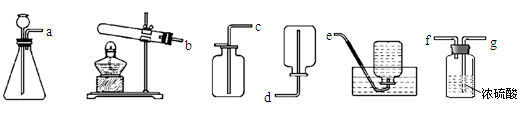
 (5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为
(5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为