题目内容
矿物燃料中常含有硫元素,在燃烧过程中会产生污染环境的SO2气体,该气体可用氢氧化钙悬浊液吸收,生成难溶于水的亚硫酸钙(CaSO3)和水.
(1)写出吸收SO2的化学反应方程式:______.
(2)根据上述化学反应,若要吸收32g SO2气体,理论上需要Ca(OH)2多少mol?(写出计算过程).
(3)若改用NaOH溶液进行吸收,所需NaOH的物质的量______(大于、等于、小于)Ca(OH)2的物质的量,写出有关反应方程:______.
解:(1)氢氧化钙和二氧化硫反应的化学方程式为:SO2+Ca(OH)2═CaSO3↓+H2O
(2)已知二氧化硫的质量,把它转化成物质的量,然后根据化学方程式,列比例式即可算出答案;
(3)根据化学方程式,吸收1摩尔二氧化硫需要1摩尔氢氧化钙,2摩尔氢氧化钠,
故答案为:大于,化学方程式为:SO2+2NaOH═Na2SO3+H2O
故答案:
(1)SO2+Ca(OH)2═CaSO3↓+H2O
(2)设需要氢氧化钙的量为X,因为nSO2=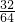 =0.5mol,
=0.5mol,
SO2+Ca(OH)2═CaSO3+H2O
1 1
0.5 x
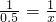
X=0.5mol
答:需要氢氧化钙的量为0.5mol
(3)大于,SO2+2NaOH═Na2SO3+H2O
分析:(1)已知反应物和生成物的化学式,写化学方程式时只要配平和注明条件即可.
(2)根据化学方程式,根据二氧化硫的质量可以计算出氢氧化钙的摩尔质量,要按照解题的步骤计算.
(3)通过比较吸收等量二氧化硫需要氢氧化钠的量和氢氧化钙的量即可得出答案.
点评:本题考查了化学方程式的书写及有关化学方程式的计算,都是重要的知识点,同学们一定要掌握解决相关问题的方法.
(2)已知二氧化硫的质量,把它转化成物质的量,然后根据化学方程式,列比例式即可算出答案;
(3)根据化学方程式,吸收1摩尔二氧化硫需要1摩尔氢氧化钙,2摩尔氢氧化钠,
故答案为:大于,化学方程式为:SO2+2NaOH═Na2SO3+H2O
故答案:
(1)SO2+Ca(OH)2═CaSO3↓+H2O
(2)设需要氢氧化钙的量为X,因为nSO2=
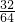 =0.5mol,
=0.5mol,SO2+Ca(OH)2═CaSO3+H2O
1 1
0.5 x
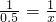
X=0.5mol
答:需要氢氧化钙的量为0.5mol
(3)大于,SO2+2NaOH═Na2SO3+H2O
分析:(1)已知反应物和生成物的化学式,写化学方程式时只要配平和注明条件即可.
(2)根据化学方程式,根据二氧化硫的质量可以计算出氢氧化钙的摩尔质量,要按照解题的步骤计算.
(3)通过比较吸收等量二氧化硫需要氢氧化钠的量和氢氧化钙的量即可得出答案.
点评:本题考查了化学方程式的书写及有关化学方程式的计算,都是重要的知识点,同学们一定要掌握解决相关问题的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目