题目内容
(2006?上海)矿物燃料中常含有硫元素,在燃烧过程中会产生污染环境的SO2气体,该气体可用氢氧化钙悬浊液吸收,生成难溶于水的亚硫酸钙(CaSO3)和水.(1)亚硫酸钙(CaSO3)的摩尔质量是______,其中Ca、S、O元素的原子个数比为______;1molCaSO3中约有______个硫原子.
(2)写出吸收SO2的化学反应方程式:______
(3)根据上述化学反应,若要吸收32g SO2气体,理论上需要______mol Ca(OH)2.
【答案】分析:(1)根据单位物质的量的物质所具有的质量,称为摩尔质量,用符号M表示.当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,进行解答;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;进行解答;
科学上把含有6.02×10^23个微粒的集体作为一个单位,叫摩尔;
(2)根据反应物与生成物和化学方程式的写配注等,写出反应化学方程式即可;
(3)先计算32g SO2为多少摩尔,根据方程式计算即可解答.
解答:解:(1)当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,所以亚硫酸钙(CaSO3)的摩尔质量为:40+32+16×3=120g/mol;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;因此CaSO3中Ca、S、O元素的原子个数比为:1:1:3;1molCaSO3中约有 6.02×1023 个硫原子.
故答案为:120g/mol; 1:1:3; 6.02×1023;
(2)氢氧化钙悬浊液吸收SO2的化学反应方程式为:SO2+Ca(OH)2=CaSO3+H2O 或 SO2+Ca(OH)2=CaSO3↓+H2O;
故答案为:SO2+Ca(OH)2=CaSO3+H2O 或 SO2+Ca(OH)2=CaSO3↓+H2O;
(3)先计算32g SO2为: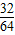 =0.5摩尔,
=0.5摩尔,
SO2+Ca(OH)2=CaSO3↓+H2O
1 1
0.5 X 则 X=0.5 mol
则 X=0.5 mol
故答案为:0.5 mol.
点评:本题考查了化学方程式的书写及摩尔质量的有关知识.
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;进行解答;
科学上把含有6.02×10^23个微粒的集体作为一个单位,叫摩尔;
(2)根据反应物与生成物和化学方程式的写配注等,写出反应化学方程式即可;
(3)先计算32g SO2为多少摩尔,根据方程式计算即可解答.
解答:解:(1)当物质的质量以克为单位时,摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,所以亚硫酸钙(CaSO3)的摩尔质量为:40+32+16×3=120g/mol;
根据标在元素符号右下角的数字表示一个分子中所含原子的个数;因此CaSO3中Ca、S、O元素的原子个数比为:1:1:3;1molCaSO3中约有 6.02×1023 个硫原子.
故答案为:120g/mol; 1:1:3; 6.02×1023;
(2)氢氧化钙悬浊液吸收SO2的化学反应方程式为:SO2+Ca(OH)2=CaSO3+H2O 或 SO2+Ca(OH)2=CaSO3↓+H2O;
故答案为:SO2+Ca(OH)2=CaSO3+H2O 或 SO2+Ca(OH)2=CaSO3↓+H2O;
(3)先计算32g SO2为:
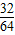 =0.5摩尔,
=0.5摩尔,SO2+Ca(OH)2=CaSO3↓+H2O
1 1
0.5 X
 则 X=0.5 mol
则 X=0.5 mol故答案为:0.5 mol.
点评:本题考查了化学方程式的书写及摩尔质量的有关知识.

练习册系列答案
相关题目
(2006?上海)某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行了以下实验:
①往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②、③中反应后试管中仍分别含有a g MnO2和a g Fe2O3.
问题:(1)MnO2、Fe2O3在上述反应中的作用是______.
(2)实验 ②、④中H2O2的浓度(w%)以______为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
问题:(3)从上表中能得出哪些结论?______.
①往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃.
②往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②、③中反应后试管中仍分别含有a g MnO2和a g Fe2O3.
问题:(1)MnO2、Fe2O3在上述反应中的作用是______.
(2)实验 ②、④中H2O2的浓度(w%)以______为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
| 浓度 时间(min) 条件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
| 加入a g Fe2O3 | 7.0 | 9.0 | 16.0 |

 (2006?上海)选做题:某学生在学习CO2的化学性质及实验室制法的原理后,联想起在实验室中用H2O2制取O2的实验.
(2006?上海)选做题:某学生在学习CO2的化学性质及实验室制法的原理后,联想起在实验室中用H2O2制取O2的实验.