题目内容
【题目】在烧杯中的盛有10g HCl和BaCl2溶液,向其中逐滴滴入溶质质量分数为13.25%的碳酸钠溶液。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。
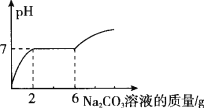
(1)通过图中可知,当碳酸钠溶液质量加到 g时,溶液中盐酸恰好处理完。
(2)请计算原烧杯溶液中氯化钡的质量分数。(要有必要的解题过程)
【答案】(1)2 (2)10.4%
【解析】
试题分析:(1)向HCl和BaCl2溶液中逐滴滴入碳酸钠溶液,先后发生以下2个反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,Na2CO3+BaCl2==BaCO3↓+2NaCl ,故通过图中可知,当碳酸钠溶液质量加到2 g时,溶液中盐酸恰好处理完
(2)由于反应:Na2CO3+BaCl2==BaCO3↓+2NaCl是后发生,故消耗的 m(NaCO3) = (6-2)×13.25%=0.53g ,然后根据Na2CO3+BaCl2==BaCO3↓+2NaCl中Na2CO3与BaCl2的质量关系,可求出BaCl2的质量,进而可计算原烧杯溶液中氯化钡的质量分数
解:设参加反应的BaCl2的质量为x
BaCl2 + Na2CO3→BaCO3↓+2NaCl
208 106
x (6-2)×13.25%
208:106=x:(6-2)×13.25%
x=1.04g
原溶液中BaCl2的质量分数=1.04g/10g×100%=10.4%

练习册系列答案
相关题目